��Ŀ����
����Ŀ��Ŀǰ��ҵ�Ϻϳɰ��ķ�Ӧԭ��Ϊ:N2(g)+3H2(g) ![]() 2NH3(g) ��H=-92.4 KJ/mol
2NH3(g) ��H=-92.4 KJ/mol
��1���ں��º��������£���Ӧƽ����ϵ�г��뵪�����ﵽ��ƽ��ʱ��c(H2)��______(����������������С�������������������ж�������ͬ)��c(N2)��c(H2)��_______��
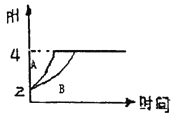
��2����ͼΪ�ϳɰ���Ӧ�ڲ�ͬ�¶Ⱥ�ѹǿ��ʹ����ͬ���������£���ʼʱ�����������������Ϊ1:3ʱ��ƽ�������а���������������ֱ���VA(NH3)��VB(NH3)��ʾ�ӷ�Ӧ��ʼ����ƽ��״̬A��Bʱ�Ļ�ѧ��Ӧ���ʣ���VA(NH3)_____VB(NH3)(����>����<������=")
��3���������º�ѹ�£���һ�ݻ��ɱ�������У��ﵽƽ��״̬ʱ��N2��H2��NH3��1mol,����ʱ�ٳ���3molN2,��ƽ��____�ƶ�(������������������������)��
����������������1:1��Ϸ�Ӧʱ���ﵽƽ�����������¶ȵ��������������____(�����������С����������ͬ)���������ѹǿ���������������___��
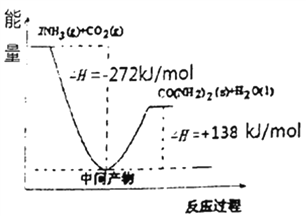
��4��H2NCOONH4�ǹ�ҵ�ϳ����ص��м����÷�Ӧ�������仯��ͼ��ʾ:��CO2�Ͱ��ϳ����ص��Ȼ�ѧ����ʽΪ________��
��5����ҵ�������ݳ��İ�����ϡ�������ա���ǡ������NH4HSO4������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳����__________��
���𰸡� ��С ���� < �� ����(����50%) ���� 2NH3��l��+CO2��g���TH2O��l��+H2NCONH2��H=-134KJ/mo1 c(H+)>c(SO42-)>c(NH4+)>c(OH-)
����������1���ں��º��������£�N2(g)+3H2(g) ![]() 2NH3(g)����Ӧƽ����ϵ�г��뵪��������Ӧ��Ũ�ȣ�ƽ�������ƶ����ﵽ��ƽ��ʱ��c(H2)����С����ƽ�ⳣ��k=c2(NH3)/c(N2)��c3(H2)��c(N2)��c(H2)=c2(NH3)/kc2(H2)���¶Ȳ��䣬k���䣬c2(NH3)����c2(H2)��С����c(N2)��c(H2)��������2���¶�Խ��ѹǿԽ��Ӧ����Խ����ͼ��֪��B��Ӧ���¶ȡ�ѹǿ����Ӧ���ʴ���VA(NH3) < VB(NH3)����3���ٺ��º�ѹ�£���һ�ݻ��ɱ�������У�N2��g��+3H2��g��
2NH3(g)����Ӧƽ����ϵ�г��뵪��������Ӧ��Ũ�ȣ�ƽ�������ƶ����ﵽ��ƽ��ʱ��c(H2)����С����ƽ�ⳣ��k=c2(NH3)/c(N2)��c3(H2)��c(N2)��c(H2)=c2(NH3)/kc2(H2)���¶Ȳ��䣬k���䣬c2(NH3)����c2(H2)��С����c(N2)��c(H2)��������2���¶�Խ��ѹǿԽ��Ӧ����Խ����ͼ��֪��B��Ӧ���¶ȡ�ѹǿ����Ӧ���ʴ���VA(NH3) < VB(NH3)����3���ٺ��º�ѹ�£���һ�ݻ��ɱ�������У�N2��g��+3H2��g��![]() 2NH3��g���ﵽƽ��״̬ʱ��N2��H2��NH3��1mol����ƽ��ʱ�������Ϊ1L�����¶���ƽ�ⳣ��K=12/1��13=1������ʱ�ٳ���3molN2�����º�ѹ�����֮�ȵ����������ʵ���֮�ȣ����������=1L��6/3=2L��Qc=
2NH3��g���ﵽƽ��״̬ʱ��N2��H2��NH3��1mol����ƽ��ʱ�������Ϊ1L�����¶���ƽ�ⳣ��K=12/1��13=1������ʱ�ٳ���3molN2�����º�ѹ�����֮�ȵ����������ʵ���֮�ȣ����������=1L��6/3=2L��Qc=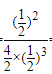 =1=k,��ƽ�ⲻ�ƶ�������������������1:1��Ϸ�Ӧʱ���ﵽƽ�������仯x����ƽ�����Ϊ1-x������Ϊ1-3x������Ϊ2x,�������������Ϊ(1-x)/(1-x+1-3x+2x)=0.5,���µ�����������������䣬Ϊ��ֵ50%���������ѹǿ�����������������������4����֪��2NH3��l��+CO2��g���TH2NCOONH4����������泥���l����H1=-272.0kJ��mol��1����H2NCOONH4��l���TH2O��l��+H2NCONH2��l����H2=+138.0kJ��mol��1�����ݸ�˹���ɣ���+�ڿɵã�2NH3��l��+CO2��g���TH2O��l��+H2NCONH2 ��l������H=-272.0kJ��mol��1+138.0kJ��mol��1=-134.0kJ��mol��1����5����ҵ�������ݳ��İ�����ϡ�������ա���ǡ������NH4HSO4������Һ�и����ӵ����ʵ���Ũ��c(H+)��Դ��NH4��ˮ���NH4HSO4���룬Ũ�����c(SO42-)ֻ��Դ��NH4HSO4���룬c(NH4+)Ҫˮ��һ���֣���c(SO42-)С���ɴ�С��˳����c(H+)>c(SO42-)>c(NH4+)>c(OH-)��
=1=k,��ƽ�ⲻ�ƶ�������������������1:1��Ϸ�Ӧʱ���ﵽƽ�������仯x����ƽ�����Ϊ1-x������Ϊ1-3x������Ϊ2x,�������������Ϊ(1-x)/(1-x+1-3x+2x)=0.5,���µ�����������������䣬Ϊ��ֵ50%���������ѹǿ�����������������������4����֪��2NH3��l��+CO2��g���TH2NCOONH4����������泥���l����H1=-272.0kJ��mol��1����H2NCOONH4��l���TH2O��l��+H2NCONH2��l����H2=+138.0kJ��mol��1�����ݸ�˹���ɣ���+�ڿɵã�2NH3��l��+CO2��g���TH2O��l��+H2NCONH2 ��l������H=-272.0kJ��mol��1+138.0kJ��mol��1=-134.0kJ��mol��1����5����ҵ�������ݳ��İ�����ϡ�������ա���ǡ������NH4HSO4������Һ�и����ӵ����ʵ���Ũ��c(H+)��Դ��NH4��ˮ���NH4HSO4���룬Ũ�����c(SO42-)ֻ��Դ��NH4HSO4���룬c(NH4+)Ҫˮ��һ���֣���c(SO42-)С���ɴ�С��˳����c(H+)>c(SO42-)>c(NH4+)>c(OH-)��