题目内容
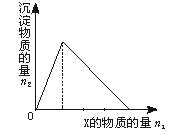
用含lmol HCl的盐酸酸化含lmol MgSO4的溶液,当向其中滴加1mol/L的Ba(OH)2
溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是

C
本题考查有关化学反应的沉淀量与反应物的量的关系图。关键要读懂图,明确反应的本质。在lmol HCl的盐酸酸化含lmol MgSO4的溶液中存在H+、Mg2+、SO42-,加入Ba(OH)2
溶液时,Ba2+先与SO42-产生BaSO4,OH-先与H+生成水,要消耗0.5L体积的Ba(OH)2溶液才能完全中和HCl,继续加Ba(OH)2溶液时,OH-就与Mg2+反应产生沉淀,沉淀增加的速度加快,加入1L体积的Ba(OH)2溶液时,SO42-沉淀完全,沉淀增加的速度变慢,要使Mg2+完全沉淀,还要继续加入0.5L体积的Ba(OH)2溶液才能完全沉淀,故只有C符合要求。

练习册系列答案
相关题目
 盐酸反应)、
盐酸反应)、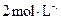 盐酸、5%NaOH溶液、饱和
盐酸、5%NaOH溶液、饱和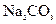 溶液、饱和
溶液、饱和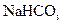 溶液和蒸馏水。
溶液和蒸馏水。
 面在同一水平面上,最后读数时右管的液面高于左管的液面,应进行的操作是
面在同一水平面上,最后读数时右管的液面高于左管的液面,应进行的操作是  。
。
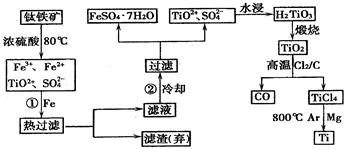
 2MgCl2+Ti , 在Ar气体中进行的目的是
2MgCl2+Ti , 在Ar气体中进行的目的是