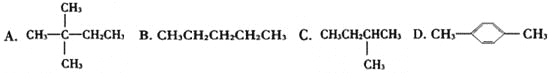题目内容
【题目】置换反应的通式可表示为:

单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若单质乙为植物光合作用的产物,则该反应的化学方程式为 。
(2)若单质甲和化合物B均具有磁性,则该反应的化学方程式为 。
(3)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为 。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 。
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常用作耐高温材料,则该反应的化学方程式 。
【答案】
(1)2F2+2H2O=4HF+O2
(2)3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
(3)2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
(4) SiO2 +2C![]() Si+2CO↑
Si+2CO↑
(5)2Mg+CO2![]() 2MgO+C
2MgO+C
【解析】
试题分析:(1)若单质乙为植物光合作用的产物,则乙为氧气,则甲为氟,化合物A为水,该反应的化学方程式为2F2+2H2O=4HF+O2,故答案为:2F2+2H2O=4HF+O2;
(2)若单质甲和化合物B均具有磁性,则甲为铁,化合物B为四氧化三铁,该反应的化学方程式为3Fe+4H2O(g) ![]() Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
(3)若化合物A是红棕色粉末状固体,化合物A为氧化铁,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,化合物B为氧化铝,该反应为铝热反应,反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;
(4)工业上利用碳与二氧化硅制备半导体材料硅,反应的化学方程式SiO2 +2C![]() Si+2CO↑,故答案为:SiO2 +2C
Si+2CO↑,故答案为:SiO2 +2C![]() Si+2CO↑;
Si+2CO↑;
(5)若单质乙是黑色非金属固体单质,乙为碳,化合物B是一种金属氧化物,常用作耐高温材料,化合物B为氧化镁,反应的化学方程式2Mg+CO2![]() 2MgO+C,故答案为:2Mg+CO2
2MgO+C,故答案为:2Mg+CO2![]() 2MgO+C。
2MgO+C。

【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 溴水 | 过滤 |
B | 甲烷(甲醛) | 银氨溶液 | 萃取 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
【题目】工业上采用乙苯脱氢制备苯乙烯,反应体系同时发生两步可逆反应,其能量变化情况如下:

(1)总反应 △H = _______。
△H = _______。
(2)下列叙述不能说明反应体系已达到平衡状态的是___________。
A.v正(CO) = v逆(CO)
B.消耗1 mol CO2同时生成1 mol H2O
C.c(CO2) = c(CO)
D.混合气体的平均相对分子质量保持不变
(3)某化学兴趣小组欲探究在相同压强条件下,CO2用量和温度条件对乙苯脱氢反应
( )的影响,并设计了如下实验:
)的影响,并设计了如下实验:
实验编号 | 乙苯(g) / mol | CO2(g) / mol | He (g) / mol | 温度 / ℃ |
I | 3.0 | 9.0 | 0 | 550 |
Ⅱ | 3.0 | 9.0 | 0 | 600 |
III | 3.0 | 0 | 9.0 | 550 |

①乙苯脱氢反应的化学平衡常数表达式为 。
② 实验III使用9.0molHe的目的是___________________。
③ 经实验测得,三组实验中乙苯的转化随时间变化如图所示。其中未知曲线代表的是实验______(填“