题目内容
溴和碘的化合物在生产和生活中有广泛的用途.
(1)市场销售的某种食用精制盐中含碘酸钾。
①碘酸钾与碘化钾在酸 性条件下发生如下反应,配平该反应的化学方程式:
性条件下发生如下反应,配平该反应的化学方程式:

②上述反应生成的I2可用四氯化碳检验,现象为________________________。
向碘的四氯化碳溶液中加入Na2SO3稀溶液,将 I2还原,以回收四氯化碳。
I2还原,以回收四氯化碳。
Na2SO3稀溶液与I2反应的离子方程式是________________________。
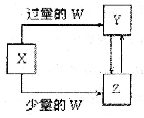
(2)海水提溴过程中溴元素的变化如下:
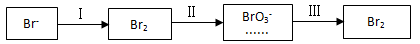
①过程I,海水显碱性,调其pH<3.5后,再通入 氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是_______________________。
氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是_______________________。
②过程II,用热空气将溴赶出,再用浓Na2CO3溶液吸收。完成并配平下列方程式。

 ③过程III,用硫酸酸化可得Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是_________________________。
③过程III,用硫酸酸化可得Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是_________________________。
④NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入 2.6molNaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
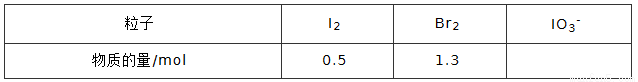
则原溶液中NaI的物质的量为_________mol.
练习册系列答案
相关题目
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A. | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
B. | 金属钠具有强还原 | 高压钠灯发出透雾性强的黄光 | Ⅰ对,Ⅱ错,有 |
C. | 可用于航天员的供氧剂 | Na2O2能和CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
D. | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ对,无 |


 性
性
 O2和18g18O2中含有的质子数均为8NA
O2和18g18O2中含有的质子数均为8NA