题目内容
3.84 g铜和一定量浓硝酸反应,当铜反应完毕时,共收集到气体的体积为2.24 L(标准状况)。试求:
(1)反应中消耗硝酸的总物质的量。
(2)把收集到气体的集气瓶倒立于盛有水的水槽中,通入多少毫升标准状况下的氧气,可以使集气瓶充满溶液?
(1)反应中消耗硝酸的总物质的量。
(2)把收集到气体的集气瓶倒立于盛有水的水槽中,通入多少毫升标准状况下的氧气,可以使集气瓶充满溶液?
(1)0.22 mol
(2)672 mL
(2)672 mL
(1)n(HNO3)=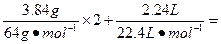 0.12mol+0.1mol=0.22mol。
0.12mol+0.1mol=0.22mol。
(2)由电子守恒得
铜失电子数=被还原硝酸得电子数=还原产物NO、NO2消耗O2得到的电子数,即
Cu失电子数=O2得电子数,
 4×n(O2),则n(O2)=0.03 mol,
4×n(O2),则n(O2)=0.03 mol,
V(O2)=0.03 mol×22.4 L·mol-1
=0.672L="672" mL。
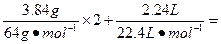 0.12mol+0.1mol=0.22mol。
0.12mol+0.1mol=0.22mol。(2)由电子守恒得
铜失电子数=被还原硝酸得电子数=还原产物NO、NO2消耗O2得到的电子数,即
Cu失电子数=O2得电子数,
 4×n(O2),则n(O2)=0.03 mol,
4×n(O2),则n(O2)=0.03 mol,V(O2)=0.03 mol×22.4 L·mol-1
=0.672L="672" mL。

练习册系列答案
相关题目