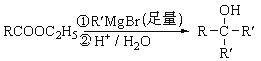题目内容
【题目】过氧化钠与二氧化氮能发生反应,某兴趣小组对此进行探究,提出了两种假设。
假设一:Na2O2+2NO2===2NaNO2+O2↑
假设二:Na2O2+2NO2===2NaNO3
[查阅资料]
2NaNO2+2HCl===2NaCl+NO↑+NO2↑+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
[实验探究]
Ⅰ.按图示装置进行实验。
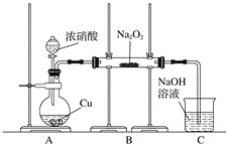
Ⅱ.通入二氧化氮至过氧化钠反应完全,然后对玻璃管中的固体物质进行检验。
[实验结论] 实验表明,过氧化钠与二氧化氮按“假设二”反应。
(1)过氧化钠与二氧化氮的反应中,氧化剂是____。
(2)装置A中反应的离子方程式是________。
(3)装置C的作用是__________。
(4)请设计实验证明装置B中的反应不符合“假设一”。
①实验操作:取玻璃管中的固体置于试管中,________;
②实验现象是________。
(5)有同学认为:只要直接观察C中导管口是否有气泡冒出,就可以判断B中的反应符合哪一种假设,这种想法________(填“对”或“不对”),原因是___________________。
【答案】过氧化钠 Cu+4H++2![]() =Cu2++2NO2↑+2H2O 吸收未充分反应的二氧化氮(或吸收尾气中的二氧化氮,防止污染空气) 向试管中加入适量盐酸 没有明显现象(或未见红棕色气体生成) 不对 若二氧化氮未充分反应,也可观察到C中导管口有气泡冒出
=Cu2++2NO2↑+2H2O 吸收未充分反应的二氧化氮(或吸收尾气中的二氧化氮,防止污染空气) 向试管中加入适量盐酸 没有明显现象(或未见红棕色气体生成) 不对 若二氧化氮未充分反应,也可观察到C中导管口有气泡冒出
【解析】
(1)过氧化钠与二氧化氮的反应中,过氧化钠中氧的化合价由-1价转化为-2价。
(2)装置A中,Cu与浓硝酸反应,生成Cu(NO3)2、NO2和H2O。
(3)因为NO2会污染环境,所以设计装置C。
(4)①实验操作:取玻璃管中的固体置于试管中,看是否有现象产生;
②从反应确定可能产生的实验现象。
(5)可从没有气体生成,是否也能产生气泡入手分析。
(1)过氧化钠与二氧化氮的反应中,过氧化钠中氧的化合价由-1价转化为-2价,则氧化剂是过氧化钠。答案为:过氧化钠;
(2)装置A中,Cu与浓硝酸反应,生成Cu(NO3)2、NO2和H2O,反应的离子方程式为Cu+4H++2![]() =Cu2++2NO2↑+2H2O。答案为:Cu+4H++2
=Cu2++2NO2↑+2H2O。答案为:Cu+4H++2![]() =Cu2++2NO2↑+2H2O;
=Cu2++2NO2↑+2H2O;
(3) 因为NO2是大气污染物,所以出现尾气处理装置,从而得出装置C的作用是吸收未充分反应的二氧化氮(或吸收尾气中的二氧化氮,防止污染空气)。答案为:吸收未充分反应的二氧化氮(或吸收尾气中的二氧化氮,防止污染空气);
(4)①从假设一的反应考虑设计实验,从而得出实验操作:取玻璃管中的固体置于试管中,向试管中加入适量盐酸;答案为:向试管中加入适量盐酸;
②产生的实验现象是没有明显现象(或未见红棕色气体生成);答案为:没有明显现象(或未见红棕色气体生成);
(5) 有同学认为:只要直接观察C中导管口是否有气泡冒出,就可以判断B中的反应符合哪一种假设,这种想法不对,原因是若二氧化氮未充分反应,也可观察到C中导管口有气泡冒出。答案为:不对;若二氧化氮未充分反应,也可观察到C中导管口有气泡冒出。

 优学名师名题系列答案
优学名师名题系列答案【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿![]() 主要成分为ZnO,另含
主要成分为ZnO,另含![]() 、
、![]() 、CuO等
、CuO等![]() 生产
生产![]() 的一种流程如图:
的一种流程如图:
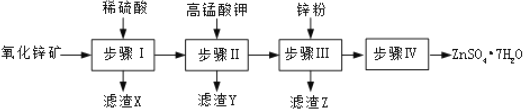
![]() 步骤Ⅰ的操作是______,滤渣A的主要成分是______。
步骤Ⅰ的操作是______,滤渣A的主要成分是______。
![]() 步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______。
步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______。
![]() 步骤Ⅱ中,在pH约为
步骤Ⅱ中,在pH约为![]() 的滤液中加入高锰酸钾,生成
的滤液中加入高锰酸钾,生成![]() 和
和![]() 两种沉淀,该反应的离子方程式为______。
两种沉淀,该反应的离子方程式为______。
![]() 步骤Ⅲ过滤后所得滤液中含有的金属阳离子有______。
步骤Ⅲ过滤后所得滤液中含有的金属阳离子有______。
![]() 已知硫酸锌的溶解度与温度之间的关系如下表:
已知硫酸锌的溶解度与温度之间的关系如下表:
温度 | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度 |
|
|
|
|
|
|
从硫酸锌溶液中获得硫酸锌晶体的实验操作为______、______、过滤。烘干操作需在减压低温条件下进行,原因是______。
![]() 取
取![]() g
g![]() 加热至不同温度,剩余固体的质最变化如图所示。
加热至不同温度,剩余固体的质最变化如图所示。
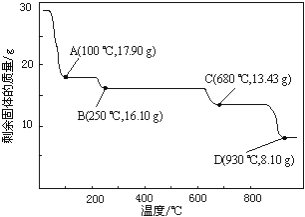
分析数据,![]() 时所得固体的化学式为______。
时所得固体的化学式为______。
![]()
![]()
![]()
![]()