题目内容
【题目】(1)在标准状况下①6.72L CH4 ②3.01×1023个HCl分子③ 13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是_________
a.体积②>①>③>④ b.密度②>③>④>①
c.质量②>①>③>④ d.氢原子个数①>③>④>②
(2)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g。则其中CO2为____________mol, CO的体积百分数为__________(保留一位小数),混合气体的摩尔质量为_______________(保留一位小数)。
(3)某混合气体中各气体的质量分数为:O2 32%,N2 28%,CO2 22%,CH4 16%,H2 2%,则此混合气体的平均摩尔质量为_____________(保留两位小数)。
【答案】bd 0.75 57.1% 34.9g/mol 22.22g/mol
【解析】
(1)根据n=![]() =
=![]() =
=![]() 计算各物质的物质的量;
计算各物质的物质的量;
(2)根据n=![]() 计算混合气体物质的量总和,设CO和CO2的物质的量分别为x mol、y mol,根据二者总质量、总物质的量列方程计算各自物质的量,气体的体积分数等于物质的量分数,根据M平=
计算混合气体物质的量总和,设CO和CO2的物质的量分别为x mol、y mol,根据二者总质量、总物质的量列方程计算各自物质的量,气体的体积分数等于物质的量分数,根据M平=![]() 计算混合气体的摩尔质量;
计算混合气体的摩尔质量;
(3)设气体总质量为100g,根据质量分数计算各自质量,再根据n=![]() 计算各自物质的量,根据M=
计算各自物质的量,根据M=![]() 计算混合气体的平均摩尔质量。
计算混合气体的平均摩尔质量。
(1)①6.72LCH4物质的量为![]() =0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6gH2S的物质的量为
=0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6gH2S的物质的量为![]() =0.4mol,④0.2molNH3;
=0.4mol,④0.2molNH3;
a.相同条件下,气体的体积之比等于物质的量之比,所以体积体积②>③>①>④,故a错误;
b.各物质的摩尔质量分别为①CH4为16g/mol②HCl为36.5g/mol③H2S为34g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,故b正确;
c.各物质的质量分别为①CH4为0.3mol×16g/mol=4.8g,②HCl为0.5mol×36.5g/mol=18.25g,③H2S为13.6g,④NH3为0.2mol×17g/mol=3.4g,所以质量②>③>①>④,故c错误;
d.各物质中H原子的物质的量分别为①CH4为0.3mol×4=1.2mol②HCl为0.5mol③H2S0.4mol×2=0.8mol④NH3为0.2mol×3=0.6mol,所以氢原子个数①>③>④>②,故d正确;
故答案为bd;
(2)混合气体物质的量总和为:39.2L÷22.4L/mol=1.75mol,设CO和CO2的物质的量分别为x mol、y mol,则:x+y=1.75、28x+44y=61,解得x=1,y=0.75;CO的体积分数=![]() ×100%=57.1%,混合气体的摩尔质量为:61g÷1.75mol=34.9g/mol;
×100%=57.1%,混合气体的摩尔质量为:61g÷1.75mol=34.9g/mol;
(3)设气体总质量为100g,则m(O2 )=32g,m(N2)=28g,m(CO2)=22g,m(CH4)=16g,m(H2)=2g,故n(O2)=![]() =1mol,n(N2)=
=1mol,n(N2)=![]() =1mol,n(CO2)=
=1mol,n(CO2)=![]() =0.5mol,n(CH4)=
=0.5mol,n(CH4)=![]() =1mol,n(H2)=
=1mol,n(H2)=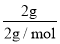 =1mol,则平均摩尔质量=
=1mol,则平均摩尔质量=![]() =22.22g/mol。
=22.22g/mol。

【题目】某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)B装置作用____。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是_____。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质正确的是___(填编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(3)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成份为___(填化学式)
(4)F装置的作用是(用化学方程式表示)____。
(5)为测定(3)中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为_____,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_____(用含a、b的式子表示)。
