题目内容
【题目】煤燃烧排放的烟气含有NOx,容易形成酸雨污染环境,可通过多种化学方法对烟气进行脱硝处理。回答下列问题:
(1)在无氧条件下,脱硝反应为:6NO(g)+4NH3(g)5N2(g)+6H2O(g)△H=-1807.0kJmol-1,T℃时,在恒容的密闭容器中,测得在不同时间NO和NH3的物质的量如下表:
时间/min | 0 | 1 | 2 | 3 | 4 |
n(NO)/mol | 1.20 | 0.90 | 0.72 | 0.60 | 0.60 |
n(NH3)/mol | 0.90 | 0.70 | 0.58 | 0.50 | 0.50 |
①下列说法正确的是______(填序号)。
A.3min后NO和NH3的浓度都不再变化,反应停止进行
B.前2min内的平均反应速率v(N2)=0.20molL-1min-1
C.达到平衡时NO的转化率为50%
D.及时分离出N2,可使该反应的反应速率增大,平衡正向移动
②若反应开始的压强为p0,则该反应的化学平衡常数Kp=______(可用分数表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)在有氧条件下,NOx也能发生脱硝反应。
①已知:N2(g)+O2(g)=2NO(g)△H=180.6kJmol-1
N2(g)+3H2(g)2NH3(g)△H=-92.4kJmol-1
H2O(g)=H2(g)+![]() O2(g)△H=241.8kJmol-1
O2(g)△H=241.8kJmol-1
则脱硝反应4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g)△H=______kJmol-1
②臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+O2(g)△H<0,反应在恒容密闭容器中进行,NO2的百分含量随压强(p)、x的变化如图所示:

则p1______p2(填“>”“<”或“=”),x表示的物理量除时间外,还可能是______。
(3)利用惰性电极电解也能对烟气进行脱硝处理。电解原理如图所示:

电极a的电极反应式为______,当电解44.8L(标准状况)含5%NO的烟气,理论上电路中通过电子的物质的量为______mol。
【答案】C ![]() p0 -1627.2 > O3的物质的量或其浓度或质量等 NO -3e + 2H2O = NO3 +4H+ 0.3
p0 -1627.2 > O3的物质的量或其浓度或质量等 NO -3e + 2H2O = NO3 +4H+ 0.3
【解析】
(1)①A. 化学反应平衡为动态平衡,正逆反应速率相等但不等于0;
B. 由化学反应速率的定义可知,需要容器的体积;
C. 根据转化率的计算公式得出结论;
D. 反应物或生成物的浓度降低,化学反应速率会减小;
②列出三段式,利用分压表达出化学平衡常数。
(2)①依据热化学方程式和盖斯定律计算得到所需热化学方程式;
②该脱硝反应是气体体积分数减小的反应,增大压强会使平衡向正反应方向移动,导致NO2的百分含量降低,据图分析;根据平衡移动原理进行分析,NO2的百分含量会随着参加反应的O3的量的增大而减少;
(3)依据图中b口放出氢气,可知b为连接电源的负极,作电解池的阴极,则a极发生氧化反应,NO转化为NO3,每消耗1 mol NO,转移电子数为 3 mol,据此计算。
①A. 3min后NO和NH3的浓度都不再变化,说明达到动态平衡,但速率不为零,故A项错误;
B. 容器的体积未知,其化学反应速率无法求出,故B项错误;
C. 3min后NO的浓度不再变化,达到平衡,n(NO) = 0.6 mol,则转化的NO的物质的量 = 1.2 mol-0.6 mol = 0.6 mol,故其转化率 = ![]() ×100% = 50%,故C项正确;
×100% = 50%,故C项正确;
D. 分离出N2,其浓度降低,反应的速率会减小,故D项错误;
故答案选C;
②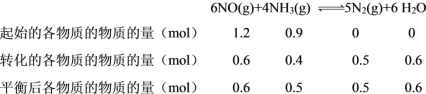
则平衡后H2O的物质的量分数ω(H2O) = ![]() =
= ![]() ,同理可得ω(N2) =
,同理可得ω(N2) = ![]() , ω(NH3) =
, ω(NH3) = ![]() , ω(NO) =
, ω(NO) = ![]() , 反应开始的压强为p0,物质的量为1.2 mol +0.9 mol = 2.1 mol,则反应后的总压p =
, 反应开始的压强为p0,物质的量为1.2 mol +0.9 mol = 2.1 mol,则反应后的总压p = ![]() =
= ![]() ,其平衡常数Kp =
,其平衡常数Kp = 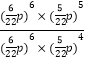 =
= ![]() =
= ![]() =
= ![]() p0,
p0,
故答案为:![]() p0;
p0;
(2)①i.N2(g)+O2(g)═2NO(g)△H=+180.6kJmol-1
ii.N2(g)+3H2(g)=2NH3(g)△H=-92.4kJmol-1
iii.2H2(g)+O2(g)═2H2O(g)△H=-483.6kJmol-1
依据盖斯定律iii×3-ii×2-i×2得到,4O(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H = -1627.2 kJ/mol;
故答案为:-1627.2;
②2NO2(g)+ O3(g) ![]() N2O5(g)+ O2(g),该反应为气体体积减小的反应,因此增大压强平衡会向正向移动,NO2的百分含量降低,从图中可以看出,p1压强大,即p1> p2;增大某一反应物的浓度可以使化学平衡向正反应方向移动,从而提高另一反应物的转化率、减小其百分含量,故x表示的物理量除时间外,还可能是O3的物质的量或其浓度或质量等;
N2O5(g)+ O2(g),该反应为气体体积减小的反应,因此增大压强平衡会向正向移动,NO2的百分含量降低,从图中可以看出,p1压强大,即p1> p2;增大某一反应物的浓度可以使化学平衡向正反应方向移动,从而提高另一反应物的转化率、减小其百分含量,故x表示的物理量除时间外,还可能是O3的物质的量或其浓度或质量等;
故答案为:>;O3的物质的量或其浓度或质量等
(3)根据图示信息可知,b口产生氢气,则为溶液中的氢离子得电子的产物,电解池中阳离子在阴极得电子发生还原反应,故b连接电源的负极,a连接电源的正极,其阳极区NO失电子被氧化为硝酸根离子,发生的电极反应式为:NO -3e + 2H2O = NO3 +4H+,电解的烟气中NO的物质的量 = ![]() = 0.1 mol,所以转移的电子数为0.1mol×3 = 0.3 mol,
= 0.1 mol,所以转移的电子数为0.1mol×3 = 0.3 mol,
故答案为:NO -3e + 2H2O = NO3 +4H+;0.3。

 阅读快车系列答案
阅读快车系列答案