题目内容
向500mL某稀硝酸溶液中加入5.6g铁粉,充分反应后,铁粉全部溶解并放出NO气体,溶液质量增加3.4g,
(1)则所得溶液中Fe2+、Fe3+的物质的量浓度之比为
(2)原稀硝酸溶液的浓度为
(1)则所得溶液中Fe2+、Fe3+的物质的量浓度之比为
4:1
4:1
,(2)原稀硝酸溶液的浓度为
0.59mol/L
0.59mol/L
.分析:(1)由信息可知铁与硝酸反应生成Fe2+和Fe3+,反应掉铁的质量与生成NO的质量之差为3.4g,利用质量关系和电子守恒来计算;
(2)由原子守恒可知,n(HNO3)=2n(Fe2+)+3(Fe3+)+n(NO),结合c=
计算.
(2)由原子守恒可知,n(HNO3)=2n(Fe2+)+3(Fe3+)+n(NO),结合c=
| n |
| V |
解答:解:(1)解:n(Fe)=
=0.1mol,生成NO的质量为5.6g-3.4g=2.2g,n(NO)=
=0.073mol,
设Fe2+和Fe3+物质的量分别为x、y,则
,
解得x=0.08mol,y=0.02mol,
所以所得溶液中Fe2+和Fe3+物质的量之比为0.08mol:0.02mol=4:1,
故答案为:4:1;
(2)由原子守恒可知,n(HNO3)=2n(Fe2+)+3(Fe3+)+n(NO)=0.08mol×2+0.02mol×3+0.073mol=0.293mol,
c=
=
=0.59mol/L,故答案为:0.59mol/L.
| 5.6g |
| 56g/mol |
| 2.2g |
| 30g/mol |
设Fe2+和Fe3+物质的量分别为x、y,则
|
解得x=0.08mol,y=0.02mol,
所以所得溶液中Fe2+和Fe3+物质的量之比为0.08mol:0.02mol=4:1,
故答案为:4:1;
(2)由原子守恒可知,n(HNO3)=2n(Fe2+)+3(Fe3+)+n(NO)=0.08mol×2+0.02mol×3+0.073mol=0.293mol,
c=
| n |
| V |
| 0.293mol |
| 0.5L |
点评:本题考查氧化还原反应的计算,明确铁与硝酸反应及NO的质量、原子守恒、电子守恒是解答本题的关键,题目难度中等,注意守恒法的应用.

练习册系列答案
相关题目
如图1所示是实验室中制取气体的一种简易装置.
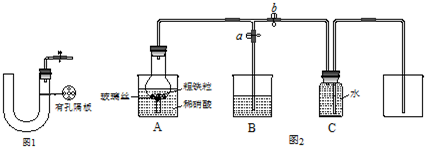
(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为 .
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为 (计算结果保留两位小数).若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、 .
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是 .B装置烧杯中液体的作用是 .当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.

(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |