题目内容
【题目】如图所示,若电解5 min时铜电极质量增加2.16g,试回答:
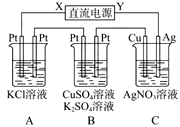
(1)电源电极X名称为______。
(2)pH变化:A ______,B ______,C ______。
(3)通电5min时,B中共收集224mL气体(标准状况),溶液体积为200mL,(设电解前后溶液不变)则通电前CuSO4溶液的物质的量浓度为 ______。
(4)若A中KCl溶液的体积也是200mL,电解后,溶液的pH是 ______(设前后体积无变化)。
【答案】 负极 增大 减小 不变 0.025molL-1 13
【解析】(1)由铜电极的质量增加,发生Ag++e-═Ag,则Cu电极为阴极,Ag为阳极,Y为正极,可知X为电源的负极,故答案为:负极;
(2)A中电解KCl溶液生成KOH,pH增大,B中电解硫酸铜溶液生成硫酸,溶液中氢离子浓度增大,pH减小,C中阴极反应为Ag++e-═Ag,阳极反应为Ag-e-═Ag+,溶液浓度不变,则pH不变,故答案为:增大;减小;不变;
(3)C中阴极反应为Ag++e-═Ag,n(Ag)= ![]() =0.02mol,则转移的电子为0.02mol,B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=
=0.02mol,则转移的电子为0.02mol,B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)= ![]() =0.025 molL-1;故答案为:0.025 molL-1;
=0.025 molL-1;故答案为:0.025 molL-1;
(4)由A中发生2KCl+2H2O![]() 2KOH+H2↑+Cl2↑~2e-,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,则c(OH-)=
2KOH+H2↑+Cl2↑~2e-,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,则c(OH-)=![]() =0.1molL-1,溶液pH=13,故答案为:13。
=0.1molL-1,溶液pH=13,故答案为:13。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D