题目内容
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是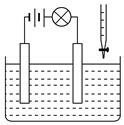
| A.盐酸中逐滴加入食盐溶液 |
| B.硫酸中逐滴加入氢氧化钠溶液 |
| C.石灰乳中逐滴加入稀盐酸 |
| D.硫酸中逐滴加入氢氧化钡溶液 |
D
解析试题分析:溶液的导电性与溶液中离子浓度以及离子带的电荷数有关系。A、盐酸中逐滴加入食盐溶液,溶液的导电性变化不大,A不正确;B、硫酸中逐滴加入氢氧化钠溶液生成硫酸钠和水,溶液的导电性变化不大,B不正确;C、石灰乳中逐滴加入稀盐酸生成氯化钙和水,溶液的导电性增强,C不正确;D、硫酸中逐滴加入氢氧化钡溶液生成硫酸钡白色沉淀和水,溶液的导电性降低,恰好反应后再加入氢氧化钡溶液,溶液的导电性开始增强,所以灯泡由亮变暗,至熄灭后又逐渐变亮,D正确,答案选D。
考点:考查考查离子反应以及溶液导电性的判断

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验,从实验可以判断:
| A.该固体粉末中一定不含有BaCl2 |
| B.该固体粉末中一定含有KNO3 |
| C.它的组成可能是CaCO3、BaCl2、CuSO4 |
| D.它的组成一定是CaCO3、Na2SO4、KNO3 |
对于电解质的导电能力,下列说法正确的是
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.导电能力强的溶液一定是浓溶液 |
| C.相同温度下,导电能力强的溶液中离子个数一定多 |
| D.相同的温度下,单位体积中的离子个数越多,阴离子或阳离子所带电荷的绝对值越大,溶液的导电能力越强 |
下列物质属于电解质的是( )
| A.干燥CuSO4 | B.CO2 | C.食盐水 | D.Fe |
下列各组离子中可能大量共存的是
| A.在能使紫色石蕊试剂变红的溶液中:Na+、SO42-、Cl-、HCO3- |
| B.在强酸性溶液中:NH4+、Ba2+、Fe2+、Br-、NO3- |
| C.在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、Al3+ |
| D.在水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、K+、CO32-、NO3- |
一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、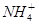 、 、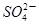 、Cl- 、Cl- |
B.c(H+)=1×10-13 mol·L-1的溶液:Na+、Ca2+、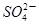 、 、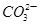 |
C.含有大量Fe3+的溶液:Na+、Mg2+、 、SCN- 、SCN- |
D.含有大量 的溶液:H+、Fe2+、 的溶液:H+、Fe2+、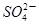 、Cl- 、Cl- |
下列物质分类正确的是( )
| A.Cu(OH)2难溶于水,属于非电解质 |
| B.SO2能与碱反应生成盐和水,属于酸性氧化物 |
| C.NH4Cl组成中不含金属离子,不属于盐 |
| D.金属铝易导电,属于电解质并且属于强电解质 |
下列各组物质间的反应不能用离子方程式“SO42-+Ba2+===BaSO4↓”表示的是
| A.MgSO4溶液和Ba(OH)2溶液 | B.BaCl2溶液和NaHSO4溶液 |
| C.明矾溶液和氯化钡溶液 | D.Na2SO4溶液和Ba(OH)2溶液 |
下列解释事实的化学方程式或离子方程式不正确的是( )
| A.钢铁发生吸氧腐蚀:2Fe+O2+2H2O=2Fe(OH)2 |
| B.SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- |
| C.利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH=2A1O2-+H2O |
D.84消毒液和洁厠灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2 +H2O +H2O |