题目内容
【题目】化学上常用AG 表示溶液中的酸碱度,AG=lgc(H+)/c(OH-)。25℃时,用0.100mol/L的NaOH溶液滴定20.00mL0.100mol/L HNO2溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是
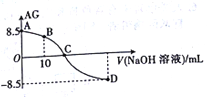
A. 25℃时,HNO2的电离平衡常数Ka=1.0×10-5.5
B. B点溶液中存在c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20.00 mL
D. D点溶液中的pH=11.25
【答案】D
【解析】A、0.100mol/L HNO2溶液,AG=lgc(H+)/c(OH-)=8.5,KW=c(H+)c(OH-)=10-14,故c(H+)=10-2.75mol/L,c(NO2-)![]() c(H+)=10-2.75mol/L,c(HNO2)= 0.100mol/L-10-2.75mol/L
c(H+)=10-2.75mol/L,c(HNO2)= 0.100mol/L-10-2.75mol/L![]() 0.100mol/L,Ka=
0.100mol/L,Ka=![]() =
=![]() =1.0×10-4.5,选项A错误;B、B点溶液为HNO2、NaNO2按1:1形成的溶液,根据电荷守恒有c(H+)+ c(Na+) =c(NO2-)+c(OH-),溶液呈酸性c(Na+)
=1.0×10-4.5,选项A错误;B、B点溶液为HNO2、NaNO2按1:1形成的溶液,根据电荷守恒有c(H+)+ c(Na+) =c(NO2-)+c(OH-),溶液呈酸性c(Na+)![]() c(HNO2),则不存在c(H+)-c(OH-)=c(NO2-)-c(HNO2),选项B错误;C、C点时,加入NaOH溶液的体积为20.00 mL形成NaNO2溶液,NaNO2为强碱弱酸盐,溶液呈碱性,AG=lgc(H+)/c(OH-)<0与图象不符合,选项C错误;D、D点溶液中AG=lgc(H+)/c(OH-)=-8.5,KW=c(H+)c(OH-)=10-14,故c(H+)=10-11.25mol/L, pH=11.25,选项D正确。答案选D。
c(HNO2),则不存在c(H+)-c(OH-)=c(NO2-)-c(HNO2),选项B错误;C、C点时,加入NaOH溶液的体积为20.00 mL形成NaNO2溶液,NaNO2为强碱弱酸盐,溶液呈碱性,AG=lgc(H+)/c(OH-)<0与图象不符合,选项C错误;D、D点溶液中AG=lgc(H+)/c(OH-)=-8.5,KW=c(H+)c(OH-)=10-14,故c(H+)=10-11.25mol/L, pH=11.25,选项D正确。答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】已知H2(g)+Br2(g)===2HBr(g) ΔH=-72 kJ/mol,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断 裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为( )
A.404B.260C.230D.200