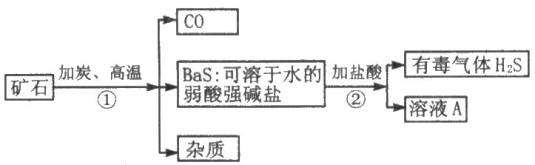
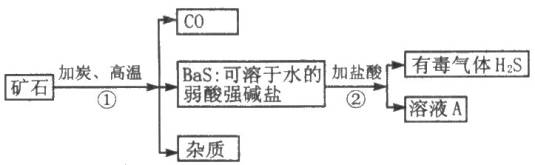
题目内容
按要求填空:
①在无土栽培中,配制1L内含0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为
②写出下列物质在熔融时的电离方程式:
K2CO3
①在无土栽培中,配制1L内含0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为
0.64mol
0.64mol
、0.02mol
0.02mol
、0.24mol
0.24mol
②写出下列物质在熔融时的电离方程式:
K2CO3
K2CO3=2K++CO32-
K2CO3=2K++CO32-
Ba(OH)2Ba(OH)2=Ba2++2OH-
Ba(OH)2=Ba2++2OH-
NaHSO4NaHSO4═Na++HSO4-
NaHSO4═Na++HSO4-
KAl(SO4)2KAl(SO4)2=K++Al3++2SO42-
KAl(SO4)2=K++Al3++2SO42-
.分析:①根据溶液中各离子的物质的量相等配制;
②先确定电解质的电离方式,再书写电离方程式.
②先确定电解质的电离方式,再书写电离方程式.
解答:解:①0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4中 n(NH4+)=n(NH4Cl)=0.5mol;
n( Cl- )=n(NH4Cl)+n( KCl)=0.5mol+0.16mol=0.66mol;
n( K+ )=n( KCl)+2n( K2SO4)=0.16mol+2×0.24mol=0.64mol;
n(SO42-)=n( K2SO4)=0.24mol;
用KCl、NH4Cl、(NH4)2SO4配制,
n((NH4)2SO4)=n(SO42-)=0.24mol;
n( KCl)=n( K+ )=0.64mol;
n(NH4Cl)=n( Cl- )-n( KCl)=0.66mol-0.64mol=0.02mol;
故答案为:0.64mol;0.02mol;0.24mol;
②这几种盐的晶体都是离子晶体,在熔融状态下能电离出自由移动的阴阳离子,
碳酸钠电离出钠离子和碳酸根离子,故答案为:K2CO3=2K++CO32-;
氢氧化钡能电离出钡离子和氢氧根离子,故答案为:Ba(OH)2=Ba2++2OH-;
硫酸氢钠能电离出钠离子和硫酸氢根离子,故答案为:NaHSO4═Na++HSO4-;
硫酸铝钾能离子出钾离子、铝离子和硫酸根离子,故答案为:KAl(SO4)2=K++Al3++2SO42-.
n( Cl- )=n(NH4Cl)+n( KCl)=0.5mol+0.16mol=0.66mol;
n( K+ )=n( KCl)+2n( K2SO4)=0.16mol+2×0.24mol=0.64mol;
n(SO42-)=n( K2SO4)=0.24mol;
用KCl、NH4Cl、(NH4)2SO4配制,
n((NH4)2SO4)=n(SO42-)=0.24mol;
n( KCl)=n( K+ )=0.64mol;
n(NH4Cl)=n( Cl- )-n( KCl)=0.66mol-0.64mol=0.02mol;
故答案为:0.64mol;0.02mol;0.24mol;
②这几种盐的晶体都是离子晶体,在熔融状态下能电离出自由移动的阴阳离子,
碳酸钠电离出钠离子和碳酸根离子,故答案为:K2CO3=2K++CO32-;
氢氧化钡能电离出钡离子和氢氧根离子,故答案为:Ba(OH)2=Ba2++2OH-;
硫酸氢钠能电离出钠离子和硫酸氢根离子,故答案为:NaHSO4═Na++HSO4-;
硫酸铝钾能离子出钾离子、铝离子和硫酸根离子,故答案为:KAl(SO4)2=K++Al3++2SO42-.
点评:本题考查了电解质在水溶液中的电离和电离方程式的书写,强电解质在水中是完全电离的,所以配制溶液时,溶质不同,配制所得的溶液中的成分及物质的量浓度可能相同;要注意硫酸氢钠在水溶液里和熔融状态下的电离方程式是不同的,注意NaHSO4=Na++HSO4- (熔融态)、NaHSO4=Na++H++SO42- (水溶液里)是学生解答的易错点.

练习册系列答案
相关题目