��Ŀ����
X��Y��ZΪ��ͬ�����ڷǽ���Ԫ�ص���̬���ʣ���һ���������ܷ������·�Ӧ��Y+X���ף�g����Y+Z���ң�g�����ס��ҿɻ����������ӻ��������Է�������С���ң�
��1��X�Ľṹʽ��
��2������Z������ȼ�տ�����Һ̬�����ӣ�Ҳ�����ɹ�̬�����ӣ���֪�������и�ԭ����������8���ӽṹ�����ĵ���ʽ��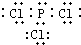
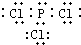 �����ʺ�Z���ʷ�Ӧ����1mol��ʱ����Ӧ�����������仯��ͼ����ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��
�����ʺ�Z���ʷ�Ӧ����1mol��ʱ����Ӧ�����������仯��ͼ����ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��
��3��ijͬѧ����ͼ����ʾװ��֤��������Z��I2����֪����������ҵ�Ũ��Һ��Ӧ����Z����a��
��4����һ��Ũ�ȵ�BaCl2��Һ��ͨ��SO2���壬δ���������ɣ�����ͨ��SO2�����ͬʱ������X��Y��Z|�е�һ�ֻ���Ԫ����ɵ�ij������������ɰ�ɫ�������ô����������
��1��X�Ľṹʽ��
N��N
N��N
����2������Z������ȼ�տ�����Һ̬�����ӣ�Ҳ�����ɹ�̬�����ӣ���֪�������и�ԭ����������8���ӽṹ�����ĵ���ʽ��
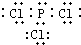
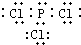
P��s��+
Cl2��g��=PCl3��l������H=-306kJ/mol
| 3 |
| 2 |
P��s��+
Cl2��g��=PCl3��l������H=-306kJ/mol
��| 3 |
| 2 |
��3��ijͬѧ����ͼ����ʾװ��֤��������Z��I2����֪����������ҵ�Ũ��Һ��Ӧ����Z����a��
����KI��KI
����KI��KI
��ˮ��Һ��������a��Ϊ��Ũ��Һ��ʵ��ʱ������������̲������嵥�����ɣ��÷�Ӧ�Ļ�ѧ����ʽ��8NH3+3Cl2=6NH4Cl+N2
8NH3+3Cl2=6NH4Cl+N2
����4����һ��Ũ�ȵ�BaCl2��Һ��ͨ��SO2���壬δ���������ɣ�����ͨ��SO2�����ͬʱ������X��Y��Z|�е�һ�ֻ���Ԫ����ɵ�ij������������ɰ�ɫ�������ô����������
Cl2
Cl2
��NH3
NH3
��
������X��Y��ZΪ��ͬ�����ڷǽ���Ԫ�ص���̬���ʣ�Y+X���ף�g����Y+Z���ң�g�����ס��ҿɻ����������ӻ������û�����ΪNH4Cl������Է�������С���ң����ΪNH3����ΪHCl��YΪH2��XΪN2��ZΪCl2��
��1��XΪN2����ԭ��֮����3�Թ��õ��Ӷԣ��ṹΪN��N��
��2��P��������ȼ�տ�����PCl3��PCl5������PCl3�����и�ԭ����������8���ӽṹ������ͼ���֪ P��s��+
Cl2��g������������1molPCl3����������Ӧ���ȣ�����ͼ���֪��Ӧ�ȣ�
��3�������������Դ��ڵ�������ԣ�������ͨ�����KI��Һ�����ɵⵥ�ʣ���Һ��������������ǿ�����ԣ������������Ӧ����NH4Cl��N2��
��4������ͨ��SO2�����ͬʱ����Cl2��������ӦΪSO2+Cl2+2H20�TH2SO4+2HCl������ͨ��SO2�����ͬʱ����NH3����Һ�д��ڴ�����SO3-��
��1��XΪN2����ԭ��֮����3�Թ��õ��Ӷԣ��ṹΪN��N��
��2��P��������ȼ�տ�����PCl3��PCl5������PCl3�����и�ԭ����������8���ӽṹ������ͼ���֪ P��s��+
| 3 |
| 2 |
��3�������������Դ��ڵ�������ԣ�������ͨ�����KI��Һ�����ɵⵥ�ʣ���Һ��������������ǿ�����ԣ������������Ӧ����NH4Cl��N2��
��4������ͨ��SO2�����ͬʱ����Cl2��������ӦΪSO2+Cl2+2H20�TH2SO4+2HCl������ͨ��SO2�����ͬʱ����NH3����Һ�д��ڴ�����SO3-��
����⣺X��Y��ZΪ��ͬ�����ڷǽ���Ԫ�ص���̬���ʣ�Y+X���ף�g����Y+Z���ң�g�����ס��ҿɻ����������ӻ������û�����ΪNH4Cl������Է�������С���ң����ΪNH3����Ϊ
HCl��YΪH2��XΪN2��ZΪCl2��
��1��XΪN2����ԭ��֮����3�Թ��õ��Ӷԣ��ṹΪN��N���ʴ�Ϊ��N��N��
��2��P��������ȼ�տ�����PCl3��PCl5������PCl3�����и�ԭ����������8���ӽṹ������ʽΪ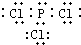 ��
��
����ͼ���֪ P��s��+
Cl2��g������������1molPCl3����������Ӧ���ȣ������Ȼ�ѧ����ʽΪ��
P��s��+
Cl2��g��=PCl3��l������H=-306 kJ/mol��
�ʴ�Ϊ��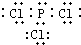 �� P��s��+
�� P��s��+
Cl2��g��=PCl3��l������H=-306 kJ/mol��
��3�������������Դ��ڵ�������ԣ�������ͨ�����KI��Һ�����ɵⵥ�ʣ���Һ��������������ǿ�����ԣ������������Ӧ����NH4Cl��N2����Ӧ�ķ���ʽΪ8NH3+3Cl2=6NH4Cl+N2��
�ʴ�Ϊ������KI��KI��8NH3+3Cl2=6NH4Cl+N2��
��4������ͨ��SO2�����ͬʱ����Cl2��������ӦΪSO2+Cl2+2H20�TH2SO4+2HCl����BaCl2��Һ������BaSO4����������ͨ��SO2�����ͬʱ����NH3����Һ�д��ڴ�����SO3-�������ɳ���
BaSO3���ʴ�Ϊ��Cl2�� NH3��
HCl��YΪH2��XΪN2��ZΪCl2��
��1��XΪN2����ԭ��֮����3�Թ��õ��Ӷԣ��ṹΪN��N���ʴ�Ϊ��N��N��
��2��P��������ȼ�տ�����PCl3��PCl5������PCl3�����и�ԭ����������8���ӽṹ������ʽΪ
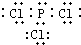 ��
������ͼ���֪ P��s��+
| 3 |
| 2 |
P��s��+
| 3 |
| 2 |
�ʴ�Ϊ��
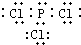 �� P��s��+
�� P��s��+| 3 |
| 2 |
��3�������������Դ��ڵ�������ԣ�������ͨ�����KI��Һ�����ɵⵥ�ʣ���Һ��������������ǿ�����ԣ������������Ӧ����NH4Cl��N2����Ӧ�ķ���ʽΪ8NH3+3Cl2=6NH4Cl+N2��
�ʴ�Ϊ������KI��KI��8NH3+3Cl2=6NH4Cl+N2��
��4������ͨ��SO2�����ͬʱ����Cl2��������ӦΪSO2+Cl2+2H20�TH2SO4+2HCl����BaCl2��Һ������BaSO4����������ͨ��SO2�����ͬʱ����NH3����Һ�д��ڴ�����SO3-�������ɳ���
BaSO3���ʴ�Ϊ��Cl2�� NH3��
���������⿼���Ϊ�ۺϣ��漰Ԫ�ص��ƶϡ������ԵıȽϡ��Ȼ�ѧ����ʽ�����⣬��Ŀ�ѶȽϴ���ע����ȷ�ƶ�Ԫ�ص�����Ϊ������Ĺؼ���

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
