题目内容
(12分)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
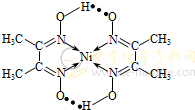
(1)配合物Ni(CO)4常温为液态,易溶于CC14、苯等有机溶剂。固态Ni(CO)4
属于____晶体,基态Ni原子的电子排布式为 ;
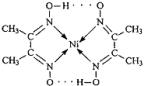
A.氢键 B.离子键 C.共价键 D.配位键
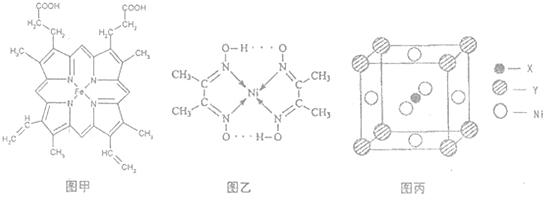
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO
分子的立体结构为 形;
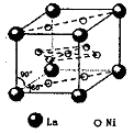
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。 该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶
胞面上,镧原子都在晶胞顶点。则该晶体的化学式为 。
解析:(1)因为Ni(CO)4常温为液态,易溶于CC14,所以固态Ni(CO)4属于分子晶
体,基态Ni原子的电子排布式为1s22s22p63s23p63d84s2;(2)由结构式知该配合物含氢键 、
配位键、共价键;(3)碳原子采取sp2杂化的物质的结构为平面型;采取sp3杂化的物质的
结构为四面体;采取sp杂化的物质的结构为直线型,则采取sp2杂化的有①、③,HCHO
为平面结构,则分子的立体结构为平面三角形。(4)根据晶胞中微粒个数求算方法:顶点
占1/8,面占1/2,棱占1/4,则镧(La)和镍(Ni)个数分别为8x1/8=1、8x1/2+1=5.

练习册系列答案
相关题目
 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有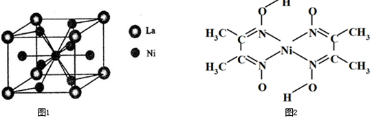
 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为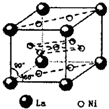 (2009?珠海二模)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
(2009?珠海二模)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.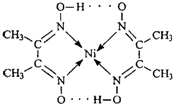 分子内的作用力有
分子内的作用力有 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有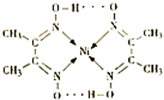 分子内的作用力有
分子内的作用力有 等,其中碳原子采取sp2杂化的分子有
等,其中碳原子采取sp2杂化的分子有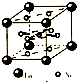
 分子内的作用力有
分子内的作用力有 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有