题目内容
(8分)阅读下表中部分短周期主族元素的相关信息:
请回答:
(1)元素T与X按原子个数比1:1形成的化合物B属于有 晶体。已知在通常条件下,39g B与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式 。
(2)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),此过程中实验现象 。
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移 mol电子
(4)在一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,写出该原电池正极的电极反应式 。
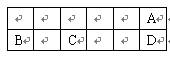
| 元素代号 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)元素T与X按原子个数比1:1形成的化合物B属于有 晶体。已知在通常条件下,39g B与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式 。
(2)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),此过程中实验现象 。
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移 mol电子
(4)在一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,写出该原电池正极的电极反应式 。
(1)离子(1分)
2Na2O2(s)+ 2CO2(g) =2Na2CO3(s)+ O2(g);△H=–4Q kJ/mol (2分)
(2)先无沉淀后有大量沉淀(1分)
(3)2(2分)
(4)O2 + 4e- + 2H2O =4OH- (2分)
2Na2O2(s)+ 2CO2(g) =2Na2CO3(s)+ O2(g);△H=–4Q kJ/mol (2分)
(2)先无沉淀后有大量沉淀(1分)
(3)2(2分)
(4)O2 + 4e- + 2H2O =4OH- (2分)
根据题中提供信息,T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,推断T为Na,X的原子最外层电子数是其内层电子数的三倍,X为O,在第三周期元素中,Y的简单离子半径最小,Y为Al,T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分,可以联想84消毒液NaClO,符合36电子,Z为Cl。T与X按原子个数比1:1形成的化合物B为Na2O2,含有离子键、非极性共价键。Al元素最高价氧化物对应水化物Al(OH)3是两性氢氧化物,有两种电离方式,酸式电离和碱式电离。AlCl3逐滴加到NaOH溶液中,先没有沉淀,后出现沉淀。离子方程式为Al3++4OH-=AlO2-+2H2O,Al3+ + 3AlO2-+ 6H2O=4Al(OH)3↓。NaClO氧化Na2SO3,SO32- + ClO- =SO42- + Cl-转移2mol电子,NaClO被还原为Cl—,Al和O2在NaOH溶液中可以形成原电池,O2做正极,得电子生成OH—。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目