题目内容
【题目】常温时向20mL 0.1molL﹣1 HA溶液中不断滴入0.1molL﹣1 NaOH溶液,pH变化如图.下列叙述正确的是( ) 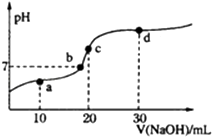
A.HA的电离方程式:HA═H++A﹣
B.水的电离程度:a点>b点
C.c点溶液:c(H+)+c(Na+)═c(A﹣)+c(HA)
D.d点溶液:c(Na+)>c(A﹣)>c(OH﹣)>c(H+)
【答案】D
【解析】解:A.c点时,两者恰好完全反应,生成单一的NaA,溶液呈碱性,说明该盐是强碱弱酸盐,HA是弱酸,HA的电离方程式:HAH++A﹣ , 故A错误;
B.a点溶液为HA和NaA的混合物,溶液呈酸性,对水的电离起抑制作用,水的电离程度:a点<b点,故B错误;
C.c点时,溶液呈碱性,得到单一的NaA,根据物料守恒c(Na+)═c(A﹣)+c(HA),故C错误;
D.d点为NaOH和NaA的混合物,物质的量之比为1:2,溶液呈碱性,故离子浓度大小顺序为:c(Na+)>c(A﹣)>c(OH﹣)>c(H+),故D正确;
故选D.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目