题目内容
对于平衡体系2SO2(g) + O2(g) 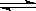 2SO3(g);ΔH<0.下列结论中正确的是
2SO3(g);ΔH<0.下列结论中正确的是
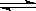 2SO3(g);ΔH<0.下列结论中正确的是
2SO3(g);ΔH<0.下列结论中正确的是| A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.48倍 |
| B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量之比为2:1 |
| C.若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率 |
| D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
B
略

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
 2NH3 (g) (正反应为放热反应)
2NH3 (g) (正反应为放热反应)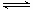 2NO(g)+O2(g)
2NO(g)+O2(g) 2NO(g)+O2(g)体系中,n (NO2)随时间的变化如表:
2NO(g)+O2(g)体系中,n (NO2)随时间的变化如表: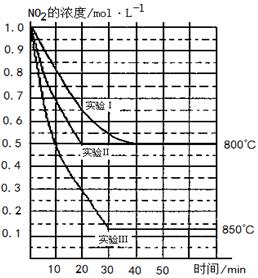
 B(OCH3)3 +3H2O中,H3BO 3的转化率(
B(OCH3)3 +3H2O中,H3BO 3的转化率(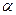 )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”). H)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
H)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。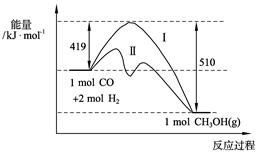
 CH3OH(g) ΔH>-91 kJ·mol-1
CH3OH(g) ΔH>-91 kJ·mol-1
 。
。
 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。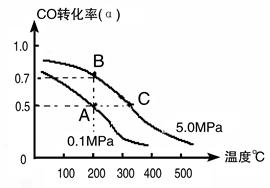
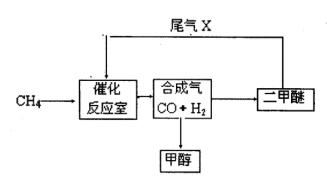
 (2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式 。
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式 。 反应Ⅰ: CO(g)+2H2(g) CH3OH(g)
反应Ⅰ: CO(g)+2H2(g) CH3OH(g) 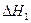
 反应Ⅱ:CO2(g)+3H2(g) CH3(g)+H2O(g)
反应Ⅱ:CO2(g)+3H2(g) CH3(g)+H2O(g)
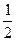 O2(g)
O2(g)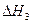 =-192.9kJ·mol-1
=-192.9kJ·mol-1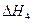 =-241.8kJ·mol-1
=-241.8kJ·mol-1
 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )