题目内容
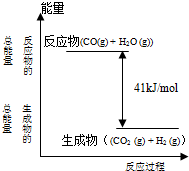
 已知一定条件下,CO(g)+H2O (g)=CO2(g)+H2(g)反应过程能量变化如图所示,下列有关该反应的说法正确的是( )
已知一定条件下,CO(g)+H2O (g)=CO2(g)+H2(g)反应过程能量变化如图所示,下列有关该反应的说法正确的是( )分析:A、考虑反应物和生成物的能量相对大小与反应的吸放热之间的关系;
B、考虑正反应反应热和逆反应反应热的关系;
C、由图可知,反应为放热反应;
D、根据反应热和物质具有能量的关系来回答判断.
B、考虑正反应反应热和逆反应反应热的关系;
C、由图可知,反应为放热反应;
D、根据反应热和物质具有能量的关系来回答判断.
解答:解:A、从图示可知,反应物能量高生成物能量低,所以该反应为放热反应,从反应热为“-”也可知此反应为放热反应,故A错误;
B、从图示可知,正反应为放热反应,正确的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol,故B错误;
C、从图示可知,反应物的能量高,生成物能量低,CO(g)与H2O(g)所具有的总能量大于 CO2(g)与H2(g)所具有的总能量,故C正确;
D、从图示可知,正反应为放热反应,则逆反应为吸热反应,故D错误.
故选C.
B、从图示可知,正反应为放热反应,正确的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol,故B错误;
C、从图示可知,反应物的能量高,生成物能量低,CO(g)与H2O(g)所具有的总能量大于 CO2(g)与H2(g)所具有的总能量,故C正确;
D、从图示可知,正反应为放热反应,则逆反应为吸热反应,故D错误.
故选C.
点评:本题考查化学反应中的能量变化与图象分析,明确反应热的表示方法、热化学反应方程式的书写即可解答,要明确正逆反应的反应热大小相等,符号相反.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
 已知一定条件下,CO(g)+H2O (g)?CO2 (g)+H2 (g)反应过程能量变化如图所示,该反应为
已知一定条件下,CO(g)+H2O (g)?CO2 (g)+H2 (g)反应过程能量变化如图所示,该反应为 CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为: 。
CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为: 。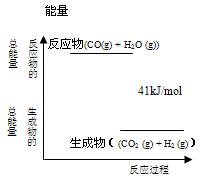
 CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为:
。
CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为:
。