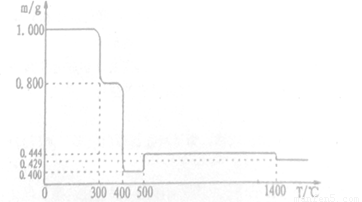
题目内容
已知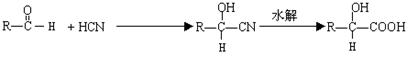
分析下图变化,试回答下列问题: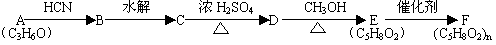
(1)写出有机物的结构简式
A C D E
(2)写出下列有关反应的化学方程式并注明有机反应类型:
D →E ;
E →F ;
(10分) CH3CH2CHO CH3CH2CH(OH)COOH CH3CH=CHCOOH CH3CH=CHCOOCH3
CH3CH=CHCOOH+CH3OH CH3CH=CHCOOCH3+H2O 酯化
CH3CH=CHCOOCH3+H2O 酯化
解析试题分析:根据已知的信息可知,含有醛基的有机物能和HCN发生加成反应,所以A是丙醛,结构简式是CH3CH2CHO。B就是CH3CH2CHOHCN。B水解生成C,则根据已知信息可知,C是CH3CH2CH(OH)COOH。C中含有羟基,而D能和甲醇发生反应,这说明C生成D的反应是羟基的消去反应,则D的结构简式是CH3CH=CHCOOH。D中含有羧基,能和甲醇发生酯化反应,所以E的结构简式是CH3CH=CHCOOCH3。E中含有碳碳双键,能发生加聚反应生成高分子化合物F。
考点:考查有机物合成与制备、结构简式、方程式以及有机反应类型的判断
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题贴近高考,基础性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和知识的迁移能力。该题的关键是记住常见官能团的结构、性质,然后结合结构简式和题意灵活运用即可。

能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应N2(g)+3H2(g) 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
|
化学键 |
H-H |
N-H |
N≡N |
|
键能/kJ·mol-1 |
436 |
a |
945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
② H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
(3)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
①写出燃料电池正极的电极反应式 。②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是 极(填”A”或”B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为 L。

(4)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 ,单位时间内通过阴离子交换膜的离子数与通过阳离子交换膜的离子数的比值为 。
②从出口D导出的溶液是 (填化学式)。
(12分) 图表法、图象法是常用的科学研究方法。请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

① 将Na—Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图像。从上图分析可知,同一主族元素原子的第一电离能I1变化规律是;__________________
_________________________________________________________________________
②上图折线中数字5代表元素在周期表中的位置是___________________________;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
Na |
O |
P |
S |
Si |
|
|
X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
②某有机化合物分子中含有S—N键,你认为该共用电子对偏向于____________原子(填元素符号)。
(3) 已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: _______________________________________________________________。