题目内容
7.分有X、Y、Z三种单质,X为金属单质,Y、Z为非金属单质,Y、Z通常情况下为气态,Y、Z一定条件下反应的产物溶于水可得无色溶液E,E能使紫色石蕊试液变红,X与E反应可生成Z和另一产物w,X、Y反应的产物F溶于水为棕黄色溶液,将Y通入w溶液也可得到F的溶液.(1)Z的化学式是H2.
(2)w的名称是氯化亚铁.
(3)棕黄色溶液F中加入氨水的离子方程式是Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+
(4)若往w溶液中滴入NaOH溶液,可产生沉淀,此沉淀在空气中发生变化的现象是白色絮状沉淀迅速变为灰绿色,最终变为红褐色; 方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 Y、Z为非金属单质,且通常情况下为气态,Y、Z一定条件下反应的产物溶于水可得无色溶液E,E能使紫色石蕊试液变红,说明E的水溶液呈酸性,应是氢气与氯气反应生成HCl,即E为HCl,X为金属单质,X与E反应可生成Z和另一产物W,则Z应为H2,X、Y反应的产物F溶于水为棕黄色溶液,应生成氯化铁,则Y为Cl2,X为Fe,W为氯化亚铁,将氯气通入氯化亚铁溶液也可得到氯化铁的溶液,据此解答.
解答 解:Y、Z为非金属单质,且通常情况下为气态,Y、Z一定条件下反应的产物溶于水可得无色溶液E,E能使紫色石蕊试液变红,说明E的水溶液呈酸性,应是氢气与氯气反应生成HCl,即E为HCl,X为金属单质,X与E反应可生成Z和另一产物W,则Z应为H2,X、Y反应的产物F溶于水为棕黄色溶液,应生成氯化铁,则Y为Cl2,X为Fe,W为氯化亚铁,将氯气通入氯化亚铁溶液也可得到氯化铁的溶液.
(1)由上述分析可知,Z的化学式为:H2,故答案为:H2;
(2)由以上分析可知,W为氯化亚铁,故答案为:氯化亚铁;
(3)氯化铁溶液与氨水反应离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(4)在氯化亚铁溶液中加入氢氧化钠,可生成白色絮状氢氧化亚铁沉淀,氢氧化亚铁不稳定,被空气氧气氧化生成氢氧化铜,可观察到:白色絮状沉淀迅速变为灰绿色,最终变为红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色絮状沉淀迅速变为灰绿色,最终变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查无机物的推断,突破口为物质的颜色变化及物质状态,侧重于学生的分析能力的考查,注意把握物质的性质及其转化,难度中等.

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案| A. | 碳、氮原子构成平面结构的晶体 | B. | 碳氮键比金刚石中的碳碳键更短 | ||
| C. | 氮原子电子数比碳原子电子数多 | D. | 碳、氮的单质的化学性质均不活泼 |
| A. | 硅酸钠溶液中通入CO2气体 SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| B. | 硫酸铝与过量氨水反应 Al3++4NH3•H2O═AlO2-↓+4NH4++2H2O | |
| C. | 氯气与氢氧化钠溶液反应Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 碳酸氢钠溶液与稀盐酸反应 HCO3-+H+═H2O+CO2↑ |
| A. | KCl | B. | HClO2 | C. | HClO4 | D. | KClO2 |
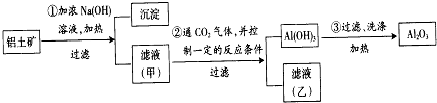


 某学生用一支底部有破洞的试管和一个广口瓶组装成制CO2的装置(如图所示),在铜网上应盛放大理石或石灰石,广口瓶中应盛有稀盐酸.若将铜网换成铁网,那么产生的后果是制得CO2不纯,其原因是(用化学方程式表示)Fe+2HCl=FeCl2+H2↑.
某学生用一支底部有破洞的试管和一个广口瓶组装成制CO2的装置(如图所示),在铜网上应盛放大理石或石灰石,广口瓶中应盛有稀盐酸.若将铜网换成铁网,那么产生的后果是制得CO2不纯,其原因是(用化学方程式表示)Fe+2HCl=FeCl2+H2↑.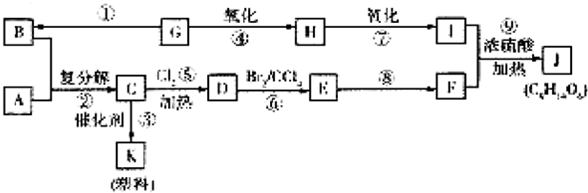
 +Br2$\stackrel{CCl_{4}}{→}$
+Br2$\stackrel{CCl_{4}}{→}$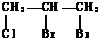 .
.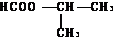 .
.