��Ŀ����
���ܵ�Ԫ���ڵؿ��еķ�Ƚϵ�(��Ҫ�������ε���ʽ����)��������Ԫ���н���31λ�����Ǵ������зḻ�ĵ�������Ϊ��������Ĺ㷺Ӧ���ṩ�˿��ܡ�
��1�������ĵ���ʽΪ ���������ܽ��е��Ĺ̶���д����Ӧ����ʽ ��
��2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ������� (������)����ˮ������ղ���Ϊ ��
��3�������е�NH4+������ϸ���Ĵ������¿�ת��ΪNO3����д�������ӷ���ʽ�� ��
��4��ijͭ���Ͻ�������ϡ������ȫ�ܽ⣬�õ���״����NO 11.2 L��������Һ�м��������ˮ����ַ�Ӧ����ˡ�����Һ������ɫ����Ϊ���е�����(�ѧʽ)�� ��������������Ϊ7.8g����Ͻ������Ϊ g��
��1�������ĵ���ʽΪ ���������ܽ��е��Ĺ̶���д����Ӧ����ʽ ��
��2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ������� (������)����ˮ������ղ���Ϊ ��
��3�������е�NH4+������ϸ���Ĵ������¿�ת��ΪNO3����д�������ӷ���ʽ�� ��
��4��ijͭ���Ͻ�������ϡ������ȫ�ܽ⣬�õ���״����NO 11.2 L��������Һ�м��������ˮ����ַ�Ӧ����ˡ�����Һ������ɫ����Ϊ���е�����(�ѧʽ)�� ��������������Ϊ7.8g����Ͻ������Ϊ g��
��1��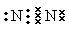 N2+O2
N2+O2 2NO�� ��2�������ʣ������
2NO�� ��2�������ʣ������
��3��NH4++2O2 NO3-+H2O+2H+ ��4��Cu(NH3)42+ ��41.1
NO3-+H2O+2H+ ��4��Cu(NH3)42+ ��41.1
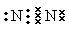 N2+O2
N2+O2 2NO�� ��2�������ʣ������
2NO�� ��2�������ʣ��������3��NH4++2O2
 NO3-+H2O+2H+ ��4��Cu(NH3)42+ ��41.1
NO3-+H2O+2H+ ��4��Cu(NH3)42+ ��41.1�����������1����N2����������Nԭ�ӹ������Ե��ӡ����Ե����ĵ���ʽΪ
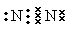 ���ڵ��������N2��O2������Ӧ�õ�NO����Ӧ�ķ���ʽΪN2+O2
���ڵ��������N2��O2������Ӧ�õ�NO����Ӧ�ķ���ʽΪN2+O2 2NO����2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ������ǵ����ʣ���������������İ��������ͨ����ˮ���϶��ɡ������ˮ������ղ���Ϊ�����ᡣ��3�������е�NH4+������ϸ���Ĵ������¿�ת��ΪNO3������Ӧ�����ӷ���ʽNH4++2O2
2NO����2��ʳ���̺���Ӫ�������У������ĸ߷��ӻ������ǵ����ʣ���������������İ��������ͨ����ˮ���϶��ɡ������ˮ������ղ���Ϊ�����ᡣ��3�������е�NH4+������ϸ���Ĵ������¿�ת��ΪNO3������Ӧ�����ӷ���ʽNH4++2O2 NO3-+H2O+2H+����4��ijͭ���Ͻ�������ϡ������ȫ�ܽ⣬������Ӧ��3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O.������Һ�м��������ˮʱ�����ڰ�ˮΪ��������ܽ������Al(OH)3���������Է�����Ӧ��Al(NO3)3+3NH3��H2O= Al(OH)3��+ 3NH4NO3��Cu(NO3)2+6NH3��H2O=[Cu(NH3)4](OH)2��2H2O+ 2NH4NO3.����Һ������ɫ����Ϊ���е�����ͭ�������ӡ����İ���ͭ����[Cu(NH3)4] 2-��n(Al(OH)3)=7.8g��78g/mol="0.1mol." m(Al)=2.7g.���ݷ���ʽ Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O��֪Al������NO�����ʵ���Ϊ0.1mol,��Cu������NO�����ʵ���Ϊ0.5mol-0.1mol=0.4mol.�ɷ���ʽ 3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��֪Cu�����ʵ���Ϊ0.6mol.m(Cu)=" 0.6mol" ��64g/mol=38.4g.���ԺϽ������Ϊ38.4g=41.1g��
NO3-+H2O+2H+����4��ijͭ���Ͻ�������ϡ������ȫ�ܽ⣬������Ӧ��3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O.������Һ�м��������ˮʱ�����ڰ�ˮΪ��������ܽ������Al(OH)3���������Է�����Ӧ��Al(NO3)3+3NH3��H2O= Al(OH)3��+ 3NH4NO3��Cu(NO3)2+6NH3��H2O=[Cu(NH3)4](OH)2��2H2O+ 2NH4NO3.����Һ������ɫ����Ϊ���е�����ͭ�������ӡ����İ���ͭ����[Cu(NH3)4] 2-��n(Al(OH)3)=7.8g��78g/mol="0.1mol." m(Al)=2.7g.���ݷ���ʽ Al��4HNO3(ϡ)=Al(NO3)3��NO����2H2O��֪Al������NO�����ʵ���Ϊ0.1mol,��Cu������NO�����ʵ���Ϊ0.5mol-0.1mol=0.4mol.�ɷ���ʽ 3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��֪Cu�����ʵ���Ϊ0.6mol.m(Cu)=" 0.6mol" ��64g/mol=38.4g.���ԺϽ������Ϊ38.4g=41.1g��
��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ


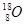
 R ��R+H2O��NaOH+Y ��Q+NaOH��V+W+H2O ��X
R ��R+H2O��NaOH+Y ��Q+NaOH��V+W+H2O ��X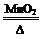 W+Y
W+Y Q+Z+H2O������M��Q��Y�ǵ��ʣ�Q��Y�ڳ��¡���ѹ��Ϊ���壬Z�������Σ��ơ��ػ������������ơ�
Q+Z+H2O������M��Q��Y�ǵ��ʣ�Q��Y�ڳ��¡���ѹ��Ϊ���壬Z�������Σ��ơ��ػ������������ơ�