题目内容
一种白色固体可能由Na+、Ba2+、Cl-、Br-、HC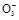 、S
、S 、S
、S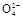 离子中的若干种组成,陶宝同学设计实验检验其组成,记录如下:
离子中的若干种组成,陶宝同学设计实验检验其组成,记录如下:
| 实验步骤 | 实验操作 | 实验现象 |
| ① | 将固体溶于水,用pH试纸检验 | 无色溶液pH=9 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | 产生气泡,CCl4层呈橙色 |
| ③ | 向②所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
下列关于固体组成的结论错误的是( )
A.肯定含有Br-,可能含有HC
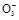
B.至少含有S
 、S
、S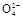 中的一种离子
中的一种离子C.肯定不含Ba2+,一定含有Cl-
D.无需焰色反应即可断定溶液中含有Na+
C
解析

练习册系列答案
相关题目
某澄清溶液,可能含有Ca2+、Na+、Cl-、CO32-、I-中的一种或几种,现做如下实验:①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色;②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。 下列关于该澄清溶液的说法中错误的是
| A.一定含有I- | B.一定含有CO32- |
| C.可能含有Cl- | D.一定含有Ca2+ |
下列关于化学实验的“目的-操作-现象-结论”的描述不正确的是( )
| | 实验目的 | 所加试剂(或操作、图示) | 实验现象 | 实验结论 |
| A | 检验稀盐酸和氢氧化钠溶液是否恰好完全反应 | 在反应后的溶液中滴加无色酚酞试液 | 无明显现象 | 恰好完全反应 |
| B | 判断海水和蒸馏水 | 蒸发结晶 | 液体消失,无残留物 | 该液体为蒸馏水 |
| C | 检验溶液中是否含碳酸根离子或碳酸氢根离子 | 加入稀盐酸再将气体通入石灰水中 | 有无色无味气体产生,且石灰水中有白色浑浊形成 | 溶液中一定含碳酸根离子或碳酸氢根离子 |
| D | 测定空气中氧气的体积分数 | 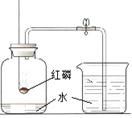 | 完全燃烧后,冷却至室温,打开弹簧夹,进入水的体积约为集气瓶中空气体积的1/5 | 氧气约占空气体积的1/5 |
下列说法正确的是
| A.除去苯中混有的少量苯酚,可加入浓溴水后过滤 |
| B.除去乙酸乙酯中混有的少量乙酸,可加入饱和碳酸钠溶液分液 |
| C.除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 |
| D.除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤 |
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是
| | 混合物 | 试剂 | 分离方法 |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 溴水 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 乙醇(乙酸) | 无 | 分液 |
下列装置能达到实验目的的是( )
| A.除去乙醇中的苯酚 | B.制取金属锰 |
| C.实验室制氨气 | D.从碘的CCl4溶液中分离I2 |
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验: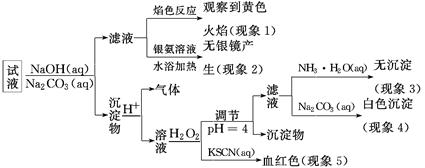
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )
| A.根据现象1可推出该试液中含有Na+ |
| B.根据现象2可推出该试液中并不含有葡萄糖酸根 |
| C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ |
| D.根据现象5可推出该试液中一定含有Fe2+ |
下列物质的检验,其结论一定正确的是( )
| A.某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,沉淀不溶解,则该溶液中一定含有SO42- |
| B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中至少有SO32-和CO32-中的一种 |
| C.取少量Na2SO3样品于试管中加水溶解后加入盐酸有气体产生,再加入BaCl2溶液有白色沉淀产生,说明Na2SO3样品已部分被氧化 |
| D.能使湿润的淀粉碘化钾试纸变蓝的一定是Cl2 |
下列实验操作与预期目的或所得结论一致的是( )。
| 选项 | 实验操作 | 实验目的或结论 |
| A | 某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀 | 说明该钠盐是硫酸钠或硫酸氢钠 |
| B | 向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和Na2CO3溶液洗涤、分液 | 得到较纯净的乙酸乙酯 |
| C | 向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 | 说明汽油中含有甲苯等苯的同系物 |
| D | 向含有少量的FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |