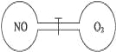
题目内容
【题目】镁、硼及其化合物在工农业生产中应用广泛。已知:硼、铝同主族;硼砂常指四硼酸钠的十水合物,化学式为Na2B4O7·10H2O。利用硼镁矿(主要成分为Mg2B2O5·H2O)制取金属镁及粗硼的工艺流程图如图所示:

(1)Mg2B2O5·H2O 中B的化合价为______价。
(2)操作②的主要步骤是_______________和过滤,从而获得MgCl26H2O。
(3)MgCl26H2O在HCl氛围中加热才能制得无水氯化镁。其原因是________________;若用情性电极电解MgCl2溶液,其阴极反应式为_____________________________。
(4)硼砂溶于90℃热水后,常用稀硫酸调pH至2~3制取H3BO3晶体,该反应的离子方程式为______;X为硼酸晶体加热完全脱水后的产物,其与Mg反应制取粗硼的化学方裎式为_____________。
(5)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+=Mg2++2H2O。常温下,若起始电解质溶液pH=1,则当pH =2时,溶液中Mg2+的浓度为___________。
【答案】 +3 加热浓缩、冷却结晶 抑制MgCl2水解 2H2O+2e-+Mg2+=H2↑+Mg(OH)2↓ B4O72-+2H++5H2O=4H3BO3 3Mg+B2O3![]() 2B+3MgO 0.045mol/L
2B+3MgO 0.045mol/L
【解析】(1)Mg元素化合价为+2价,氧元素化合价-2价,依据化合价代数和为0计算可得到硼元素化合价为+3价。(2)从溶液中得到结晶水合物为防止失去结晶水,不能直接蒸发结晶,应采用蒸发浓缩、冷却结晶的方法。(3)MgCl2是强酸弱碱盐,水解显酸性,加热会促进Mg2+水解,在HCl氛围中加热,可抑制MgCl2水解;情性电极电解MgCl2溶液,阴极上由水电离的H+得电子发生还原反应生成H2,同时Mg2+会结合OH-生成沉淀,因此阴极的电极反应式为:2H2O+2e-+Mg2+=H2↑+Mg(OH)2↓。(4)由化学式可知,硼砂溶于90℃热水后,用稀硫酸调pH至2~3制取H3BO3,B的化合价并没有发生变化,根据原子守恒和电荷守恒可知反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3;X为H3BO3晶体加热脱水的产物,则为B2O3,与Mg反应生成粗硼和氧化镁,反应的化学方程式为3Mg+B2O3![]() 2B+3MgO。(5)若起始pH=1,则pH=2时溶液中,氢离子浓度减小0.1molL-1-0.01 molL-1=0.09 molL-1,依据总反应式Mg+H2O2+2H+=Mg2++2H2O可得c(Mg2+)=0.045 molL-1。
2B+3MgO。(5)若起始pH=1,则pH=2时溶液中,氢离子浓度减小0.1molL-1-0.01 molL-1=0.09 molL-1,依据总反应式Mg+H2O2+2H+=Mg2++2H2O可得c(Mg2+)=0.045 molL-1。

【题目】运用化学反应原理的有关知识回答下列问题:
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2 △H=-989.2 kJ·mol-1,有关键能数据如下表:
化学键 | Si-O | O=O | Si-Si |
键能kJ·mol-1 | X | 498.8 | 176 |
则X的值为_________。
(2)加热N2O5,依次发生的分解反应为①N2O5![]() N2O3+O2,②N2O3
N2O3+O2,②N2O3![]() N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
(3)一只规格为amL的滴定管,其尖嘴部分充满溶液,管内液面在mmL处,当液面降到n mL处时,下列判断正确的是_________。
A.流出溶液的体积为(m-n)mL B.流出溶液的体积为(n-m)mL
C.管内溶液体积等于(a-n)mL D.管内溶液体积多于nmL
(4)已知某二元酸(H2A)溶液按下式发生一级和二级电离:H2A=H++HA-;HA-![]() H++A2-,且0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是_________0.11 mol·L-1(填“<”“>”或“=”),理由是__________。
H++A2-,且0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是_________0.11 mol·L-1(填“<”“>”或“=”),理由是__________。