题目内容
【题目】摩尔盐[(NH4)2Fe(SO4)26H2O]是分析化学中的重要试剂.摩尔盐隔绝空气加热可完全分解生成红棕色固体和其他产物.某学习小组欲探究其分解产物.
(1)甲组同学设计了如图1所示实验装置. 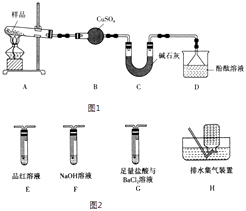
(i)实验中,装置B中观察到的现象是 .
(ii)碱石灰的主要作用是 .
(iii)装置D中观察到酚酞溶液变红色,由此可知摩尔盐分解的产物中有(写化学式).
(iv)设计实验验证装置A中固体残留物不含FeO:(简要说明实验操作、现象和结论).
(2)乙组同学认为摩尔盐受热分解的产物中还含有SO2、SO3和N2 . 为进行验证,用甲组实验中的装置A和下列如图2所示装置进行实验.
说明此固体产物不含FeO|多余
(i)乙组同学的实验装置中,依次连接的合理顺序为A、 . 装置G中盐酸的作用是
(ii)实验中,准确称量摩尔盐7.8400g,充分加热反应后,测得装置A中固体残留物的质量为1.6000g,装置G中生成白色沉淀的质量为3.4950g,装置H中收集到112mL N2(标准状况下),写出摩尔盐受热分解的化学方程式: . (分解产物被充分吸收,不考虑其损失)
【答案】
(1)白色固体变蓝色;吸收分解产生的酸性气体;NH3;取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色,
(2)G、E、F、H;吸收氨气并将溶液酸化,排除SO2的干扰;4[(NH4)2Fe(SO4)2?6H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O
【解析】解:(1)(i)装置B无水硫酸铜是检验分解产物水,所以看到的现象为白色固体变蓝色,所以答案是:白色固体变蓝色;(ii)碱石灰的主要作用是吸收分解产生的酸性气体,所以答案是:吸收分解产生的酸性气体;(iii)装置D中观察到酚酞溶液变红色,说明有碱性气体产生即NH3 , 所以由此可知摩尔盐分解的产物中有NH3;所以答案是:NH3;(iv)利用二价铁离子具有还原性设计实验检验,实验设计为:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色,证明此固体产物不含FeO,
所以答案是:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色,说明此固体产物不含FeO;(2)(i)要检验生成SO3(g)、SO2(g)及N2 , 在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3 , 再通过品红溶液检验SO2 , 用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、E、F、H,由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰;
所以答案是:G、E、F、H;吸收氨气并将溶液酸化,排除SO2的干扰;(ii)根据以上分析,测得装置A中固体残留物即氧化铁的质量为1.6000g,则n(Fe2O3)= ![]() =0.01mol,装置G中生成白色沉淀即硫酸钡的质量为3.4950g,则根据氯化钡溶液检验SO3及硫原子守恒,所以n(SO3)=
=0.01mol,装置G中生成白色沉淀即硫酸钡的质量为3.4950g,则根据氯化钡溶液检验SO3及硫原子守恒,所以n(SO3)= ![]() =0.015mol,装置H中收集到112mL N2(标准状况下)即
=0.015mol,装置H中收集到112mL N2(标准状况下)即 ![]() =0.005mol,根据得失电子守恒,则生成二氧化硫的物质的量为:
=0.005mol,根据得失电子守恒,则生成二氧化硫的物质的量为: ![]() =0.025mol,所以生成物中Fe2O3:SO3:SO2:N2=2:3:5:1;所以根据原子守恒,摩尔盐受热分解的化学方程式为:4[(NH4)2Fe(SO4)26H2O]
=0.025mol,所以生成物中Fe2O3:SO3:SO2:N2=2:3:5:1;所以根据原子守恒,摩尔盐受热分解的化学方程式为:4[(NH4)2Fe(SO4)26H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O,所以答案是:4[(NH4)2Fe(SO4)26H2O]
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O,所以答案是:4[(NH4)2Fe(SO4)26H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O.
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O.

 字词句段篇系列答案
字词句段篇系列答案【题目】下列物质的体积约为22.4L的是( )
A.标准状况下1molH2O
B.20℃、101kPa时36.5gHCl
C.常温常压下17gNH3
D.标准状况下0.4mol H2和0.6molO2的混合气