题目内容
氯酸钾是一种强氧化剂,多用来制造火柴和烟花等。制取氯酸钾的方法有两种:第一种,无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾。
①电解池中电极反应的方程式是
阴极: ,阳极: 。
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目 。
第二种,无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
③第二种方法中制得氯酸钾的化学方程式是 ,该反应能够进行的原因是 。
④已知下列各物质的价格如下表:
| 物质 | NaCl | KCl | NaClO3 | KClO3 | KOH |
| 价格(元/50kg) | 500 | 1900 | 4200 | 26000 | 10600 |
从经济效益分析,上述方法中的第 种方法更好,理由是
。
① 2H++2e―==H2↑,2Cl――2e―== Cl 2↑
②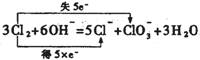
③NaClO3+KCl==KClO3+NaCl;四种物质中氯酸钾的溶解度最小,可以从溶液中析出,使反应向着生成氯酸钾的方向进行。
④第二种
第一种方法中生成KClO3时只利用了原料KCl的1/6,其余5/6又恢复为原料KCl,而KCl的价格高于NaCl,这在经济上是低效益的。

氯酸钾是一种强氧化剂,多用来制造火柴和烟花等。制取氯酸钾的方法有两种:第一种,无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾。
①电解池中电极反应的方程式是
阴极: ,阳极: 。
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目 。
第二种,无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
③第二种方法中制得氯酸钾的化学方程式是 ,该反应能够进行的原因是 。
④已知下列各物质的价格如下表:
| 物质 | NaCl | KCl | NaClO3 | KClO3 | KOH |
| 价格(元/50kg) | 500 | 1900 | 4200 | 26000 | 10600 |
从经济效益分析,上述方法中的第 种方法更好,理由是
。
(11分)氯酸钾是一种强氧化剂,多用来制造火柴和烟花等。制取氯酸钾的方法有两种:第一种,无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾。
①电解池中电极反应的方程式是
阴极: ,
阳极: 。
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目 。
第二种,无隔膜电解热的氯化钠水溶液,然后用电解生成物相互反应的产物与等物质的量氯化钾的水溶液混合制得氯酸钾。
③第二种方法中制得氯酸钾的化学方程式是 ,该反应能够进行的原因是 。
④已知下列各物质的价格如下表:
物质 | NaCl | KCl | NaClO3 | KClO3 | KOH |
价格(元/50kg) | 500 | 1900 | 4200 | 26000 | 10600 |
从经济效益分析,上述方法中的第 种方法更好,理由是
。