��Ŀ����
��14�֣�������Ƴɺϳ�����CO��H2�������Ƴɼ״����������湩Ӧ���ŵ�ȼ�͡�
��֪���� CH4 (g) �� H2O (g) �� CO (g)��3H2 (g) ��H1��+206.2kJ��mol��1
�� CH4��g����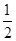 O2��g����CO��g����2H2��g�� ��H2=��35.4 kJ��mol-1
O2��g����CO��g����2H2��g�� ��H2=��35.4 kJ��mol-1
�� CH4 (g) �� 2H2O (g) ��CO2 (g) ��4H2 (g) ��H3��+165.0 kJ��mol��1
��1��CH4(g)��CO2 (g)��Ӧ����CO(g)��H2(g)���Ȼ�ѧ����ʽΪ ��
��2����ԭ��ѡ�����Դ���ýǶȣ��ȽϷ����ٺ͢ڣ�Ϊ�ϳɼ״����ü����ƺϳ��������˷���Ϊ ������ţ�����ԭ���� ��
��3���ϳ����е�H2����������NH3���ڽ���ϳ���ǰ����Cu(NH3)2Ac��Һ���������е�CO����ֹ�ϳ����еĴ����ж����䷴Ӧ�ǣ�
Cu(NH3)2Ac + CO + NH3  [Cu(NH3)3]Ac��CO ��H��0
[Cu(NH3)3]Ac��CO ��H��0
Cu(NH3)2Ac��Һ����CO��������������Ӧ�� ��
��4����CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ��ʾ������ͼ��A��BΪ�����̼����������ͨ����飬�ڱ�״���£����ļ������VL��
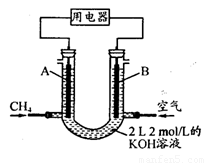
�� O<V��44.8 Lʱ������ܷ�Ӧ����ʽΪ ��
�� 44.8 L<V��89.6 Lʱ�������缫��ӦΪ ��
�� V=67.2 Lʱ����Һ������Ũ�ȴ�С��ϵΪ ��
��1��CH4 (g)��CO2 (g) ��2CO (g)��2H2 (g) ��H��+247.4 kJ��mol��1��2�֣�
��2���ڣ�2�֣� ѡ��CH4����ȫȼ���ƺϳ���ʱ���ų�������ͬʱ�õ���CO��H2���ʵ���֮��Ϊ1��2����ǡ����ȫ��Ӧ�ϳɼ״�����2�֣�
��3�����¡���ѹ��2�֣�
��4�� ��CH4 + 2O2 + 2KOH ��K2CO3 + 3H2O ��2�֣�
��CH4��8e��+ 9CO32��+3H2O ��10 HCO3�� ��2�֣�
��c(K��)��c(HCO3��)��c(CO32��)��c(OH��)��c(H+) ��2�֣�
����������1���١�2���ۼ��õ�CH4 (g)��CO2 (g) ��2CO (g)��2H2 (g)�����ԡ�H��+247.4 kJ��mol��1��
��2����Ϊ�ϳ����ǻ�����壬��CO��H2���ɼ״��������1�U2���ڷ�Ӧ���ж��ߵ����ǡ����1�U2��
��3����Ϊ��Ӧ�������С�ķ��ȵĿ��淴Ӧ���������˵������ǵ��¡���ѹ��
��4�������е�����������4mol������������ǡ����44.8L����2molʱ��������ǡ����2mol̼���ơ�������ǡ����89.6L����4molʱ��������ǡ����4mol̼�����ơ���V=67.2 L����3molʱ�����������̼���ƣ�����̼�����ƣ������ʵ����ֲ���1mol��2mol��

 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�