题目内容
【题目】下列关于镁、铝的说法正确的是( )
A. 铝制品在空气中能稳定存在是因为铝不活泼
B. 浓HNO3、浓H2SO4能用铝制器皿盛装是因为铝与浓HNO3、浓H2SO4不反应
C. 镁、铝均能与NaOH溶液反应
D. 铝与Fe2O3发生铝热反应是利用了Al的还原性比Fe强
【答案】D
【解析】
A.铝是一种比较活泼的金属,铝在空气中与氧气反应,在其表面生成一层致密的氧化物薄膜,这是铝在空气中能够稳定存在的原因,故A错误;
B.常温下,铝和浓硫酸、浓硝酸发生钝化,在铝表面生成一层致密的氧化物薄膜而阻止进一步反应,而不是铝和浓硫酸、浓硝酸不反应,故B错误;
C.镁与NaOH溶液不反应,而Al能与NaOH溶液反应,故C错误;
D.铝与Fe2O3发生铝热反应,2Al + Fe2O3![]() 2Fe + Al2O3,Al的还原性比Fe强,故D正确;
2Fe + Al2O3,Al的还原性比Fe强,故D正确;
答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
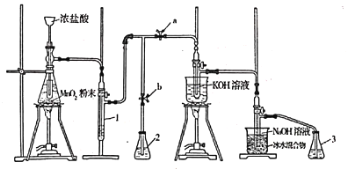
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(夹持和净化装置省略)。仅用以下实验装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的液体 | b中的物质 | c中收集的气体 | d中的液体 |
A | 浓氨水 | 碱石灰 | NH3 | H2O |
B | 浓硝酸 | Cu | NO2 | H2O |
C | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
D | 稀硝酸 | Cu | NO | NaOH溶液 |
A. A B. B C. C D. D