题目内容
(6分) 0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后产物为CO2、CO和H2O(g)。产物经过浓H2SO4后,质量增加10.8 g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2 g,最后气体再通过碱石灰被完全吸收,质量增加17.6 g。(提示:同一个C原子连两个羟基是不稳定结构)通过计算解决以下两个问题,要有必要计算过程:
(1)试推断该有机物的分子式。
(2)若0.2 mol该有机物恰好能与9.2 g金属钠完全反应,试确定该有机物的结构简式。
(1)试推断该有机物的分子式。
(2)若0.2 mol该有机物恰好能与9.2 g金属钠完全反应,试确定该有机物的结构简式。
(1)C2H6O2;(2)HO—CH2—CH2—OH
试题分析:n(H2O)= 10.8 g÷18g/mol=0.6mol;n(CO)=3.2g÷16g/mol=0.2mol;n(CO2)(总)= 17.6 g÷44g/mol=0.4mol。所以有机物燃烧产生的CO2的物质的量是0.4mol-0.2mol=0.2mol。则0.2mol的有机物中含有C:0.4mol,含有H:0.6×2=1.2mol;含有O:(0.6+0.2+0.2×2)mol-0.4×2mol=0.4mol所以1mol的该有机物含有C原子2mol;含有H原子6mol;含有O原子2mol.因此该物质的化学式是C2H6O2;(2)n(Na)= 9.2 g÷23g/mol=0.4mol,则每一个分子中含有2个羟基。因为在一个C原子上连两个羟基是不稳定结构,所以该有机物的结构简式是HO—CH2—CH2—OH。

练习册系列答案
相关题目
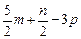 ) mol
) mol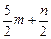 ) mol
) mol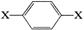 其1H核磁共振谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2。下列关于该有机物的说法错误的是
其1H核磁共振谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2。下列关于该有机物的说法错误的是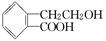 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.
 ,则此烃不可能具有的名称是
,则此烃不可能具有的名称是