题目内容
【题目】某学习小组的同学查阅相关资料知氧化性:Cr2O72﹣>Fe3+ , 设计了盐桥式的原电池,见图.盐桥中装有琼脂与饱和K2SO4溶液.下列叙述中正确的是( ) 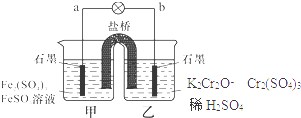
A.甲烧杯的溶液中发生还原反应
B.乙烧杯中发生的电极反应为:2Cr3++7H2O﹣6e﹣=Cr2O72﹣+14H+
C.外电路的电流方向是从b到a
D.电池工作时,盐桥中的SO42﹣ 移向乙烧杯
【答案】C
【解析】解:由于氧化性Cr2O72﹣>Fe3+ , 即Cr2O72﹣可以将Fe2+氧化为Fe3+ , 故在原电池中,Fe2+失电子被氧化,故a极为负极;Cr2O72﹣得电子被还原,故b极为正极.
A、Fe2+失电子被氧化,即甲池发生氧化反应,故A错误;
B、乙烧杯中Cr2O72﹣得电子被还原:Cr2O72﹣+6e﹣+14H+=2Cr3++7H2O,故B错误;
C、外电路中电流由正极流向负极,即由b流向a,故C正确;
D、原电池中,阴离子移向负极,即SO42﹣ 移向甲烧杯,故D错误.
故选C.

练习册系列答案
相关题目