题目内容
【题目】下图中的实验装置可以用于实验室制取乙炔。请填空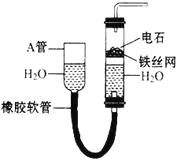
(1)图中,A管的作用是____________。制取乙炔的化学反应方程式为____________。
(2)乙炔通入酸性KMnO4溶液中,发生____________反应,可以观察到____________现象。
(3)乙炔燃烧的化学方程式为________________________,点燃乙炔前应该先________________________。
【答案】 调节水面的高度来控制反应的发生和停止 CaC2+2H2O→Ca(OH)2+CH≡CH↑ 氧化 紫色酸性高锰酸钾溶液逐渐褪色 2CH≡CH+5O2![]() 4CO2+2H2O 验纯
4CO2+2H2O 验纯
【解析】(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色;能够和溴水发生加成反应;
(3)乙炔燃烧的化学方程式为 2CH≡CH+5O2 ![]() 4CO2+2H2O;乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度。
4CO2+2H2O;乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度。

【题目】一定温度下,体积均为0.25 L的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,达到平衡。下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1,达到平衡。下列说法正确的是( )
容器编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
N2 | H2 | NH3 | NH3 | ||
① | 500 | 1 | 3 | 0 | 0.5 |
② | 500 | 0.6 | 1.8 | 0 | |
③ | 550 | 0 | 0 | 2 | a |
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,容器②中H2的转化率大于25%
C. a<0.5
D. 起始时向容器①中充入1 mol N2、2 mol H2、0.5 mol NH3,则反应将向逆反应方向进行