��Ŀ����
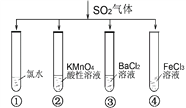
����Ŀ������������Ҫ�������ϸ�����������������Ҳ�����ƣ�Ŀǰ�Ƚϳ���ġ���ˮ��������ϸ�Ч������������������ԭ����ͼ��ʾ��

(1)���������������������__________(���ɢϵ����)�������������д��������������׳������ˮ�����ϲ����ܵ���ҪĿ����____________________��
(2)��֪��2NO2(g)![]() 2NO(g)��O2(g)����H1����115.2 kJ��mol��1��2O3(g)
2NO(g)��O2(g)����H1����115.2 kJ��mol��1��2O3(g) ![]() 3O2(g)����H2����286.6 kJ��mol��1��д��������NO���ò���NO2��O2���Ȼ�ѧ����ʽ��__________________________��
3O2(g)����H2����286.6 kJ��mol��1��д��������NO���ò���NO2��O2���Ȼ�ѧ����ʽ��__________________________��
(3)�����ܱ���ϵ��NO��������![]() ֵ�ı仯�Լ����¶ȵı仯������ͼ��ʾ��NO��������
ֵ�ı仯�Լ����¶ȵı仯������ͼ��ʾ��NO��������![]() ֵ������������Ҫԭ����__________________�����¶ȸ���100 ��ʱ��O3�ֽ�������Լ��ߵ���ԭ�ӣ�NOת�������¶����߶����͵Ŀ���ԭ��ƽ����¶�����ƽ�����ƣ��ڷ�����Ӧ__________________��
ֵ������������Ҫԭ����__________________�����¶ȸ���100 ��ʱ��O3�ֽ�������Լ��ߵ���ԭ�ӣ�NOת�������¶����߶����͵Ŀ���ԭ��ƽ����¶�����ƽ�����ƣ��ڷ�����Ӧ__________________��

(4)��֪2NO(g)��2CO(g)![]() 2CO2(g)��N2(g)����H����744 kJ��mol��1��Ϊ�о�����β��ת��Ϊ�������ʵ��йط�Ӧ�����ܱ������г���10 mol CO��8 mol NO��������Ӧ����ͼ��ʾΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ����ѹǿΪ10 MPa���¶�ΪT1ʱ�����¶���ƽ�ⳣ��Kp��__________MPa��1(����2λ��Ч����)(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)��
2CO2(g)��N2(g)����H����744 kJ��mol��1��Ϊ�о�����β��ת��Ϊ�������ʵ��йط�Ӧ�����ܱ������г���10 mol CO��8 mol NO��������Ӧ����ͼ��ʾΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ����ѹǿΪ10 MPa���¶�ΪT1ʱ�����¶���ƽ�ⳣ��Kp��__________MPa��1(����2λ��Ч����)(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)��

(5)���õ绯ѧ��������ˮ�е�NH4+����ʹ��ת��ΪNH3��ѭ�����á��ں�NH4+�ķ�ˮ�м����Ȼ��ƣ��ö��Ե缫��⡣װ����ͼ��ʾ�����ʱa���ĵ缫��ӦʽΪ______________________________��

���𰸡����� ��������ԭ��(����SO2��NO2�백ˮ�ĽӴ����)���������е�SO2�Ͳ�����NO2��ֱ���ˮ���� NO(g)��O3(g)![]() NO2(g)��O2(g) ��H����200.9 kJ��mol��1 n��O3��/n��NO��ֵ����O3Ũ�����ӣ�������ƽ��NO(g)��O3(g)
NO2(g)��O2(g) ��H����200.9 kJ��mol��1 n��O3��/n��NO��ֵ����O3Ũ�����ӣ�������ƽ��NO(g)��O3(g) ![]() NO2(g)��O2(g) �����ƶ���NO���������� NO2��O
NO2(g)��O2(g) �����ƶ���NO���������� NO2��O![]() NO��O2 0.089 2NH4+��2e��=2NH3����H2��(��2H2O��2e��=H2����2OH����NH4+��OH��=NH3����H2O)
NO��O2 0.089 2NH4+��2e��=2NH3����H2��(��2H2O��2e��=H2����2OH����NH4+��OH��=NH3����H2O)
��������
(1)���ý���ĵ�Ӿ���Խ��������о���������������������백ˮ�ĽӴ�������ӳ���Ӧʱ�䣻
(2)���ø�˹������H2����H1�ٳ���2���ɵã�
(3)����ƽ���ƶ�ԭ�����з�����
(4)��������ʽ���м��㣻
(5)�ö��Ե缫���淋��䰱��������Ϊ������笠����ӵõ����ӷ�����ԭ��Ӧ���ɰ�����������Ϊȷ�������ܻӷ���ȥ��
(1)���ý���ĵ�Ӿ���Խ��������о���������������������ɢ����ˮ�����������ܣ��������������백ˮ�ĽӴ�������ӳ���Ӧʱ�䣬���������е�SO2�Ͳ�����NO2��ֱ���ˮ���ա�
(2) ��֪����2NO2(g)![]() 2NO(g)��O2(g) ��H1����115.2kJ��mol��1��
2NO(g)��O2(g) ��H1����115.2kJ��mol��1��
��2O3(g)![]() 3O2(g) ��H2����286.6kJ��mol��1��
3O2(g) ��H2����286.6kJ��mol��1��
���ݸ�˹���ɣ��ɢ�-�ٵ÷�ӦNO(g)��O3(g)![]() NO2(g)��O2(g) ��H=��H2����H1=��200.9 kJ��mol��1��
NO2(g)��O2(g) ��H=��H2����H1=��200.9 kJ��mol��1��
(3)����ƽ���ƶ�ԭ��������n(O3)/n(NO)��ֵ��O3Ũ�����ӣ�������ƽ��NO(g)��O3(g)![]() NO2(g)��O2(g) �����ƶ���ʹNO���������� ���¶ȸ���100 ��ʱ��O3�ֽ����ɻ��Լ��ߵ���ԭ�ӣ�NOת���ʽ��ͣ�˵����Ӧ��NO2ת��ΪNO���ʿ��Ƿ����˷�ӦNO2��O
NO2(g)��O2(g) �����ƶ���ʹNO���������� ���¶ȸ���100 ��ʱ��O3�ֽ����ɻ��Լ��ߵ���ԭ�ӣ�NOת���ʽ��ͣ�˵����Ӧ��NO2ת��ΪNO���ʿ��Ƿ����˷�ӦNO2��O![]() NO��O2��
NO��O2��
(4)�������Ϊ���ʵ���������
2NO(g)��2CO(g) ![]() N2(g)��2CO2(g)
N2(g)��2CO2(g)
��ʼ(mol): 8 10 0 0
�仯(mol): ��2x ��2x x 2x
ƽ��(mol): 8��2x 10��2x x 2x
���������![]() ��
��![]() ��25%�����x��2��
��25%�����x��2��
��Kp��![]() ��
�� ��0.089MPa��1��
��0.089MPa��1��
(5)�ö��Ե缫���淋��䰱��������Ϊ������笠����ӵõ����ӷ�����ԭ��Ӧ���ɰ�����������Ϊȷ�������ܻӷ���ȥ����Ҫ��֤a��Ϊ�����������������ܽ���ˮ�У��缫��ӦʽΪ2NH4+��2e��===2NH3����H2����2H2O��2e��===H2����2OH����NH4+��OH��===NH3����H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�