题目内容
【题目】氧化还原反应的应用比较广泛。阅读下面的材料,结合相关化学知识回答下列问题。
(1)黑火药主要是硝酸钾、硫磺、木炭三者粉末的混合物,在点燃条件下,其化学反应式主要为:KNO3+S+C →N2↑+CO2↑+K2S
①在黑火药燃烧的反应中,氧化剂为____,被氧化的物质为____。
②根据化学反应式分析,一个硫原子参与反应时___(得到或失去)___个电子。
(2)把Cl2通入浓氨水中,发生如下反应:3Cl2 +8NH3=6NH4Cl +N2。用双线桥表示反应的电子转移方向和数目:____。
(3)已知存在下列反应:①ClO3-+5Cl-+6H+ =3Cl2+3H2O②2FeCl2+Cl2=2FeCl3。则ClO3- 、Fe3+ 、Cl2三种微粒氧化能力由强到弱的顺序是____
【答案】KNO3、S C 得到 2 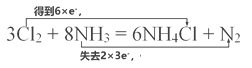 ClO3- >Cl2>Fe3+
ClO3- >Cl2>Fe3+
【解析】
(1)在氧化还原反应中,化合价降低失电子的物质作氧化剂,化合价升高的元素被氧化;根据硫元素的化合价变化分析;
(2)根据氧化还原反应的规律及双线桥法作答;
(3)根据氧化剂的氧化性大于氧化产物的氧化性;
(1)①得到电子的物质是氧化剂,KNO3中氮原子的化合价从+5价降低到0价,所以KNO3是氧化剂,S的化合价从0价降低到-2价,所以S也是氧化剂,C的化合价从0价升高到+4价,所以被氧化的物质是C,故答案为:KNO3、S;C;
②化学反应式主要为:KNO3+S+C →N2↑+CO2↑+K2S中S元素的化合价从0价降低到-2价,一个硫原子参与反应时得到2个电子,故答案为:得到;2;
(2)反应中氯气中氯元素从0价降低到-1价,得到6![]() e-,NH3中N元素从-3价升高到0价,失去电子数为2
e-,NH3中N元素从-3价升高到0价,失去电子数为2![]() 3e-,故双线桥法表示为:
3e-,故双线桥法表示为: ;
;
(3)根据①ClO3-+5Cl-+6H+ =3Cl2+3H2O可知氧化性:ClO3-> Cl2;根据②2FeCl2 + Cl2 = 2FeCl3可知氧化性:Cl2 >Fe3+,所以氧化性强弱的顺序为:ClO3-> Cl2 >Fe3+;
。

【题目】利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 0.100 | 0.076 | 0.060 | 0.060 | 0.050 | 0.050 |
N2 | 0 | 0.012 | 0.020 | 0.020 | 0.025 | 0.025 |
CO2 | 0 | 0.012 | 0.020 | 0.020 | 0.011 | 0.011 |
(1
(2)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。




