题目内容
用标准NaOH溶液滴定未知浓度的盐酸溶液,以测定盐酸的浓度,下列操作使测定结果偏高的是( )A.未知浓度盐酸用滴定管量取,该滴定管用蒸馏水洗涤后未用待测液润洗
B.装待测液的锥形瓶,洗涤后未干就盛入待测液
C.滴定开始时,用俯视法观察碱式滴定管刻度,其余操作正确
D.滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液
答案:CD
解析:
解析:
| 因盐酸和NaOH反应物质的量之比为1∶1,所以滴定计算式为c(HCl)= A中未用待测液盐酸润洗,造成酸浓度降低,酸量减少,则耗碱量V(NaOH)偏小,实验结果偏低。 B中,锥形瓶中有少量蒸馏水,不会使耗碱量V(NaOH)改变,故对测定结果无影响。 C中开始时用俯视法观察碱式滴定管刻度,读数偏小,最终使耗碱量V(NaOH)偏大,则c(HCl)偏高。 D中滴定结束,滴定管尖嘴处悬挂碱液也已算入耗碱量,则V(NaOH)偏大,测定结果偏高。
|

练习册系列答案
相关题目
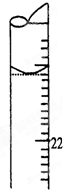 某学生用0.1000mol?L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol?L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
 某学生用0.1000mol?L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol?L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: ( )
( )