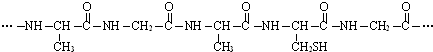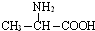题目内容
16.据报道科研人员应用计算机模拟出结构类似C60的物质N60.已知:①N60分子中每个氮原子均以N-N键结合三个N原子而形成8电子稳定结构;
②N-N键的键能为167kJ•mol-1.请回答下列问题.
(1)N60分子组成的晶体为分子晶体,其熔、沸点比N2高(填“高”或“低”),原因是N60和N2都是分子晶体,N60相对分子质量大于N2,所以N60的熔、沸点比N2高
(2)1mol N60分解成N2时吸收或放出的热量是放出热量13230kJ(已知N≡N键的键能为942kJ•mol-1),表明稳定性N60<(填“>”、“<”或“=”)N2.
(3)由(2)列举N60的用途(举一种)N60分解为N2时释放大量的能量,可用作高能炸药和火箭推进剂等.
分析 (1)根据晶体的构成微粒判断;分子晶体中结构和组成相似,其相对分子质量越大沸点越高;
(2)N原子占有其形成的每一个N-N键的$\frac{1}{2}$,一个N原子完全占有的N-N键的数目是3×$\frac{1}{2}$,60个N原子形成N-N键的总数为1.5×60=90,先计算N60中N-N键的数目再计算总键能;含键能大稳定性差;
(3)利用N60分解为N2时释放出的大量能量,为生产生活、国防等服务.
解答 解:(1)N60晶体的构成微粒为分子,所以属于分子晶体;分子晶体中结构和组成相似,其相对分子质量越大熔、沸点越高,N60和N2都是分子晶体,N60相对分子质量大于N2,所以N60的熔、沸点比N2高,
故答案为:分子;高;N60和N2都是分子晶体,N60相对分子质量大于N2,所以N60的熔、沸点比N2高;
(2)每个N原子均以氮氮单键结合三个氮原子,每个氮氮键被2个氮原子共用,每个氮原子有1.5个氮氮键,1个N60分子的结构中含有90个N-N键,则1molN60的总键能为167kJ•mol-1×90mol=15030KJ,生成30molN≡N键的键能为942kJ•mol-1×30mol=28260KJ,则反应放出能量为28260KJ-15030KJ=13230 KJ,1mol N60分解成N2时放出热量13230KJ,N60能量高,所以稳定性N60<N2,
故答案为:放出热量13230;<;
(3)N60分解为N2时释放大量的能量,可用作高能炸药和火箭推进剂等,
故答案为:N60分解为N2时释放大量的能量,可用作高能炸药和火箭推进剂等.
点评 本题考查了元素化合物知识,明确的C60和N60结构相似性是解题关键,注意分子晶体熔沸点规律,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如图处理:下列说法正确的是( )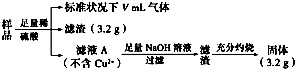
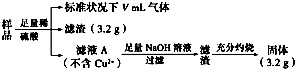
| A. | V=44.8 | |
| B. | 原样品中Fe元素的质量分数为38.89% | |
| C. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| D. | 样品中CuO的质量为4.0 g |
4.下列说法正确的是( )
| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成4种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
1.除去下列物质中少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 过滤 |
| B | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
8.实验室用30%左右的硫酸溶液(约3.7mol•L-1)与锌粒反应制取氢气.下列措施中不可能加快反应速率的是( )
| A. | 适当升高温度 | B. | 将锌粒改为锌粉 | ||
| C. | 将所用硫酸加适量水适当稀释 | D. | 寻找一种合适的催化剂并加入其中 |
5.苹果酸的结构简式为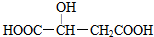 ,下列说法错误的是( )
,下列说法错误的是( )
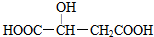 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 苹果酸能发生取代反应、消去反应和缩聚反应 | |
| C. | 1 mol苹果酸最多可与1 mol Na2CO3发生复分解反应 | |
| D. | 与苹果酸官能团种类和个数均相同的同分异构体还有两种 |
6.下列说法正确的是( )
| A. | 分馏石油得到的各个馏分都是纯净物 | |
| B. | 石油的裂解是为了提高汽油等轻质油的产量和质量 | |
| C. | 煤中含有苯、甲苯、二甲苯等有机化合物 | |
| D. | 不沾锅的表面涂覆的聚四氟乙烯是一种有机高分子材料 |
 .
.