题目内容
【题目】实验小组的同学欲对一粗盐样品进行初步提纯。所用实验仪器或用品如下:

(1)D的名称是_______;
(2)提纯的步骤是:溶解、过滤、_______、计算产率;
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中“二低”的含义是__________________________;
(4)实验小组通过正确的计算发现,所得实验结果与该粗盐的实际含量对比,实验测得的结果比实际偏低,请分析可能的原因:_________________________________。
(5)如何用密度为1.84 g·cm-3、质量分数为98%的浓硫酸来配制0.5 mol·L-1的H2SO4溶液500 mL?简述配制过程_______________________.
【答案】 蒸发皿 蒸发 滤纸上沿低于漏斗边缘,液面低于滤纸上沿 称取时出错,蒸发有液体溅出等 配制步骤有计算、量取、稀释、转移、洗涤、定容、摇匀、装瓶等操作
【解析】试题分析:(1)根据图示判断D仪器的名称;(2)粗盐提纯的步骤一般有溶解、过滤、蒸发结晶等步骤;(3)根据过滤操作的要点分析;(4)可以从导致精盐减少的原因解答;(5)根据配制一定物质的量浓度的溶液的的步骤分析解答。
解析:(1)根据图示,仪器D是蒸发皿;(2)粗盐提纯的步骤有:溶解、过滤、蒸发、计算产率等;(2)两低主要是为了防止滤液漫过漏斗、漫过滤纸而起不到过滤的目的,所以“二低”是指滤纸上沿低于漏斗边缘,液面低于滤纸上沿;(4)在过滤、蒸发操作时损失了液体的质量造成精盐质量减小或称量时操作或读数错误都可能使实验测得的结果比实际偏低;(5)用密度为1.84 g·cm-3、质量分数为98%的浓硫酸来配制0.5 mol·L-1的H2SO4溶液500 mL的步骤有计算、量取、稀释、转移、洗涤、定容、摇匀、装瓶等操作。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(I)随新物质加入量(m)的变化曲线。
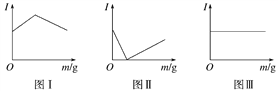
以下4个导电性实验,其中与图Ⅰ、图Ⅱ、图Ⅲ对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入NH3·H2O至过量
③澄清石灰水中通入CO2至过量
④NH4Cl溶液中逐渐加入适量NaOH固体
图 选项 | 图Ⅰ | 图Ⅱ | 图Ⅲ |
A | ① | ② | ③ |
B | ④ | ②③ | ① |
C | ③ | ①② | ④ |
D | ② | ①③ | ④ |
A. A B. B C. C D. D