题目内容
(12分)Ⅰ.某些化学反应可表示为:A+B→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,该反应离子方程式为____________ ________。
(2)若A为黑色固体,C、D均为气体,则该反应的化学方程式为_____ ___。
(3)若C为NaCl,D是能使澄清石灰水变浑浊的无色有刺激性气味的气体,若A为盐,B为酸,则A是 或__ ____(填化学式)。
(4)若A是铁的一种氧化物,B是硫酸,则A与B反应的化学方程式为_ ___。
Ⅱ.某些化学反应可表示为:A+B +H2O→C+D。请回答下列问题:
若反应物与生成物中各有一种物质含有Si元素,请写出2个符合要求的化学反应方程式
,
Ⅰ(1)Cl2+2OH-=Cl-+ClO-+H2O
(2)若A为黑色固体,C、D均为气体,则A应该是碳,B是浓硫酸,所以反应的化学方程式是C+2H2SO4(浓)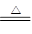 CO2↑+SO2↑+2H2O。
CO2↑+SO2↑+2H2O。
(3)D是能使澄清石灰水变浑浊的无色有刺激性气味的气体,所以D是SO2,因此B是盐酸,则A是Na2SO3或NaHSO3。
(4)若A是铁的一种氧化物,B是硫酸,则根据生成物有两种硫酸盐可知,A应该是四氧化三铁,所以反应的方程式是Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O。
ⅡNa2SiO3+CO2+H2O=H2SiO3↓+Na2CO3((或NaHCO3)、Si+2NaOH+H2O= Na2SiO3+2H2↑
解析试题分析:Ⅰ(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,所以A应该是氯气,B是氢氧化钠,则反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O。
(2)C+H2SO4=CO2+SO2+H2O
(3)Na2SO3 NaHSO3
(4)Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2Ozxxk
Ⅱ反应物与生成物中各有一种物质含有Si元素,所以该反应可以是可溶性硅酸盐和酸反应制取硅酸的,或者是单质硅和强碱溶液的反应,因此方程式分别是Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3((或NaHCO3)、Si+2NaOH+H2O= Na2SiO3+2H2↑。
考点:考查物质的判断和反应方程式的书写
点评:在根据方程式进行物质的判断时,需要熟练掌握各种物质的性质,特别是化学性质,以及物质之间的转化,然后灵活运用即可。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号) 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式) 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其中两种化合物的化学式: 、 。
(4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被MnO2催化分解,向酸性FeCl2溶液中先加入KSCN,再加入该溶液,现象是 ,
反应的离子方程式是 , 。
(5)⑤的最高价氧化物对应水化物与⑥反应的化学方程式
(6)写出实验室制备⑧的化学反应方程式