题目内容
8.如图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;V、VI是气体收集装置,根据要求回求答下列问题: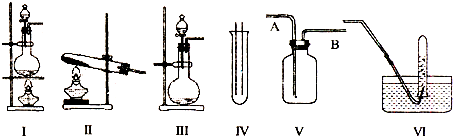
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择Ⅲ;(填序号)
若用I装置制取氯气,则浓盐酸应盛放在分液漏斗(填I中的仪器名称).
写出实验室制取氯气的化学方程式MnO2+4HC1(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnC12+C12↑+2H2O.
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从A口通入.用化学方法检验氯气收集满的方法是将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满.
(3)实验室制取氯气,多余的氯气要进行尾气处理,一般将尾气通入到氢氧化钠溶液中,其发生反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
分析 (1)若用CaCO3与盐酸反应制CO2,为固体和液体的反应,常温下可进行;用I装置制取氯气,浓盐酸放在分液漏斗中,浓盐酸和二氧化锰在加热条件下反应生成氯气、氯化锰和水;
(2)氯气密度比空气大,用向上排空法收集,可用湿润的淀粉碘化钾验满;
(3)氯气与氢氧化钠溶液反应,可用于吸收尾气.
解答 解:(1)若用CaCO3与盐酸反应制CO2,为固体和液体的反应,常温下可进行,可选择Ⅲ装置,用I装置制取氯气,浓盐酸放在分液漏斗中,浓盐酸和二氧化锰在加热条件下反应生成氯气、氯化锰和水,反应的方程式为MnO2+4HC1(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnC12+C12↑+2H2O,
故答案为:Ⅲ;分液漏斗;MnO2+4HC1(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnC12+C12↑+2H2O;
(2)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口;氯气的氧化性大于碘的氧化性,所以氯气能置换出碘化钾中的碘,且碘遇淀粉变蓝色,所以可用湿润的淀粉KI试纸检验是否收集满了氯气.
故答案为:A;将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满;
(3)氯气有毒,逸出会污染大气,所以不能让氯气逸出;氯气和水能反应是盐酸和次氯酸,盐酸和次氯酸是酸,都能和碱反应,所以可用氢氧化钠溶液吸收氯气,
故答案为:氢氧化钠;2NaOH+Cl2=NaCl+NaClO+H2O.
点评 本题考查制备实验,侧重于氯气的实验室制法、气体的检验等知识点,难度不大,注意根据反应物的状态及反应条件选择相应的装置.

练习册系列答案
相关题目
18.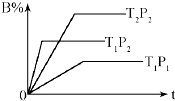 已知某可逆反应 mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确是( )
已知某可逆反应 mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确是( )
 已知某可逆反应 mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确是( )
已知某可逆反应 mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确是( )| A. | T2>T1?P1>P2 m+n>p??△Η<0 | B. | T1>T2?P1<P2 m+n<p??△Η>0 | ||
| C. | T1<T2?P1<P2 m+n<p??△Η<0 | D. | T1>T2?P1<P2 m+n>p??△Η>0 |
3.浓度为0.01mol•L-1的H2SO4溶液500mL,加水稀释到1000mL,取出10mL,这10mL溶液中含有H+物质的量浓度(单位:mol•L-1)为( )
| A. | 0.005 | B. | 0.01 | C. | 0.002 | D. | 0.05 |
20.下列关于反应N2+3H2═2NH3的反应速率说法一定正确的是( )
| A. | 每消耗1molN2的同时消耗2molNH3 | |
| B. | 相同时间内消耗28gN2与消耗6gH2的反应速率相同 | |
| C. | 当v(N2)=3v(H2)时表示反应已达平衡 | |
| D. | 2min内H2减少3mol,则v(N2)=0.5mol/(L•min) |
17.对如表各组中的实验步骤和现象,分析正确的一项是( )
| 选项 | 实验现象 | 原因分析 |
| A | 证明酸性条件下H2O2氧化性比I2强 | 碘化钠溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$$\stackrel{稀硝酸溶液及淀粉}{→}$溶液变蓝色 |
| B | 新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl、HClO显酸性,使石蕊变红,Cl2具有强氧化性,使其褪色 |
| C | SO2通人溴水中,溴水褪色 | SO2具有漂白性,使其褪色 |
| D | 向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀 | 在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成了CO2、SO2 |
| A. | A | B. | B | C. | C | D. | D |
18.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1mol•L-1 NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 在0.1mol•L-1 CH3COOH中:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 0.2mol•L-1NaHCO3溶液与0.1mol•L-1KOH溶液等体积混合:c(Na+)═2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.2mol•L-1氨水与0.1mol•L-1HCl溶液等体积混合:c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-) |
 的名称为3,3,4-三甲基己烷
的名称为3,3,4-三甲基己烷 的名称为3-甲基-1-戊烯
的名称为3-甲基-1-戊烯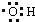
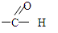 .
.