题目内容
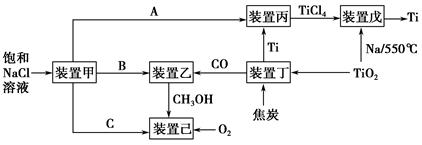
党的十八大报告中首次提出“美丽中国”的宏伟目标。节能减排是中国转型发展的必经之路,工业生产中联合生产是实现节能减排的重要措施,下图是几种工业生产的联合生产工艺:
请回答下列问题:
(1)装置甲为电解池,根据图示转化关系可知:A为____________(填化学式),阴极反应式为____________。
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是_________________________________________________
装置戊进行反应时需要的环境为________(填字母序号)。
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)??CH3OH(g) ΔH<0。
①该反应在不同温度下的化学平衡常数(K)如下表:
符合表中的平衡常数x的数值是________(填字母序号)。
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
反应从2 min到4 min之间,H2的平均反应速率为________。反应达到平衡时CO的转化率为________。反应在第2 min时改变了反应条件,改变的条件可能是________(填字母序号)。
A.使用催化剂 B.降低温度
C.增加H2的浓度
(4)装置己可以看作燃料电池,该燃料电池的负极反应式为____________ ________________________________________________。

请回答下列问题:
(1)装置甲为电解池,根据图示转化关系可知:A为____________(填化学式),阴极反应式为____________。
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是_________________________________________________
装置戊进行反应时需要的环境为________(填字母序号)。
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)??CH3OH(g) ΔH<0。
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
符合表中的平衡常数x的数值是________(填字母序号)。
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| | c(CO) | c(H2) | c(CH3OH) |
| 0 min | 0.8 mol·L-1 | 1.6 mol·L-1 | 0 |
| 2 min | 0.6 mol·L-1 | y | 0.2 mol·L-1 |
| 4 min | 0.3 mol·L-1 | 0.6 mol·L-1 | 0.5 mol·L-1 |
| 6 min | 0.3 mol·L-1 | 0.6 mol·L-1 | 0.5 mol·L-1 |
反应从2 min到4 min之间,H2的平均反应速率为________。反应达到平衡时CO的转化率为________。反应在第2 min时改变了反应条件,改变的条件可能是________(填字母序号)。
A.使用催化剂 B.降低温度
C.增加H2的浓度
(4)装置己可以看作燃料电池,该燃料电池的负极反应式为____________ ________________________________________________。
(1)Cl2 2H2O+2e-=H2↑+2OH-
(2)进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净 C
(3)①B ②0.3 mol·L-1·min-1 62.5% A
(4)CH3OH+8OH--6e-=CO32—+6H2O
(2)进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净 C
(3)①B ②0.3 mol·L-1·min-1 62.5% A
(4)CH3OH+8OH--6e-=CO32—+6H2O
(1)装置甲为电解饱和NaCl溶液的装置,阳极为Cl-失电子,被氧化为Cl2,阴极水电离的H+得电子,生成氢气和NaOH。
(2)装置丙和装置戊的作用是提纯Ti。装置戊中发生的反应是钠还原TiCl4的反应,而高温条件下钠与氧气反应,需要无氧和无水环境。
(3)①ΔH<0,所以正反应为放热反应,故平衡常数随着温度的升高而降低,x<2.041,而且因为是可逆反应,平衡常数不可能为0。②根据表格中CO或CH3OH的浓度可知y=1.2 mol·L-1,所以反应从2 min到4 min之间,H2的平均反应速率为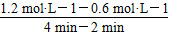 =0.3 mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为
=0.3 mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为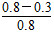 ×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。
×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。
(4)装置己是由甲醇、氧气、NaOH溶液构成的燃料电池,负极反应为甲醇在碱性条件下失电子的反应。
(2)装置丙和装置戊的作用是提纯Ti。装置戊中发生的反应是钠还原TiCl4的反应,而高温条件下钠与氧气反应,需要无氧和无水环境。
(3)①ΔH<0,所以正反应为放热反应,故平衡常数随着温度的升高而降低,x<2.041,而且因为是可逆反应,平衡常数不可能为0。②根据表格中CO或CH3OH的浓度可知y=1.2 mol·L-1,所以反应从2 min到4 min之间,H2的平均反应速率为
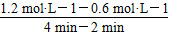 =0.3 mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为
=0.3 mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为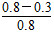 ×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。
×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。(4)装置己是由甲醇、氧气、NaOH溶液构成的燃料电池,负极反应为甲醇在碱性条件下失电子的反应。

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
 C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)反应时间t的变化曲线如图所示,下列说法正确的是( )
CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)反应时间t的变化曲线如图所示,下列说法正确的是( )
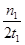 mol·L-1·min-1
mol·L-1·min-1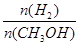 减小
减小 Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。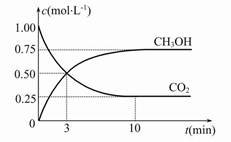
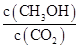 增大的是 (填符号)。
增大的是 (填符号)。
 b.
b. c.
c. d.HI
d.HI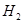 的物质的量随时间的变化如图所示。0~2min内的平均反应速率
的物质的量随时间的变化如图所示。0~2min内的平均反应速率 _________。
_________。
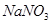 b.
b.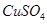 c.
c. d.
d.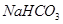
 2NH3
2NH3 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。