题目内容
A.由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
(1)下列说法正确的是 .
(a)BF3和NH3都是含有极性键的非极性分子
(b)CO2、HCN分子中都含有两个σ键和两个π键
(c)H2S、O3分子都是直线形
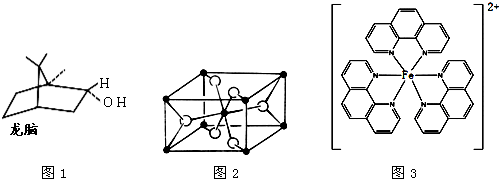
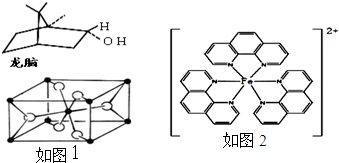
(d)一种双环单萜龙脑(如图1)分子中有4个手性碳原子
(2)NO是人体中的信号分子,有关说法正确的 .
(a)第一电离能N大于O (b)电负性O大于N
(c)NO+的结构为:N≡O+
(d)N、O元素在周期表中都处于p区
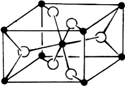
(3)TiO2的天然晶体中,最稳定的一种晶体结构如图2,白球表示: 原子.
(4)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,其中Fe2+在基态时核外电子排布式为: ;实验室测定铁的含量可用配位剂邻二氮菲(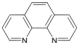 ),它能与Fe2+形成红色配合物(如图3),该配离子中Fe2+配位数为 .
),它能与Fe2+形成红色配合物(如图3),该配离子中Fe2+配位数为 .
(5)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构: .

(1)下列说法正确的是
(a)BF3和NH3都是含有极性键的非极性分子
(b)CO2、HCN分子中都含有两个σ键和两个π键
(c)H2S、O3分子都是直线形
(d)一种双环单萜龙脑(如图1)分子中有4个手性碳原子
(2)NO是人体中的信号分子,有关说法正确的
(a)第一电离能N大于O (b)电负性O大于N
(c)NO+的结构为:N≡O+
(d)N、O元素在周期表中都处于p区
(3)TiO2的天然晶体中,最稳定的一种晶体结构如图2,白球表示:
(4)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,其中Fe2+在基态时核外电子排布式为:
 ),它能与Fe2+形成红色配合物(如图3),该配离子中Fe2+配位数为
),它能与Fe2+形成红色配合物(如图3),该配离子中Fe2+配位数为(5)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构:
分析:(1)(a)不同非金属元素之间存在极性键,正负电荷重心重合的分子是非极性分子;
(b)1个单键是1个σ键,1个双键中含有1个σ键和1个π键,1个三键中含有1个σ键和2个π键;
(c)根据价层电子对互斥理论确定微粒的空间构型;
(d)根据手性碳原子连接4个不同的原子或原子团;
(2)a.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
b.同周期,自左而右,元素电负性逐渐增大;
c.氮气分子和是等电子体,等电子体结构相似,以氮气分子的结构书写NO+的结构;
d.根据价层电子排布可以确定元素的位置;
(3)利用均摊法计算各种原子个数,再结合化学式判断;
(4)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理写出Fe2+基态离子核外电子排布式;含有孤电子对的原子和含有空轨道的离子间能形成配位键;
(5)在二个乙酸分子间中,羧基上的氢原子与另一个乙酸分子中碳氧双键上氧原子形成氢键.
(b)1个单键是1个σ键,1个双键中含有1个σ键和1个π键,1个三键中含有1个σ键和2个π键;
(c)根据价层电子对互斥理论确定微粒的空间构型;
(d)根据手性碳原子连接4个不同的原子或原子团;
(2)a.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
b.同周期,自左而右,元素电负性逐渐增大;
c.氮气分子和是等电子体,等电子体结构相似,以氮气分子的结构书写NO+的结构;
d.根据价层电子排布可以确定元素的位置;
(3)利用均摊法计算各种原子个数,再结合化学式判断;
(4)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理写出Fe2+基态离子核外电子排布式;含有孤电子对的原子和含有空轨道的离子间能形成配位键;
(5)在二个乙酸分子间中,羧基上的氢原子与另一个乙酸分子中碳氧双键上氧原子形成氢键.
解答:解:(1)(a)BF3和NH3都是含有极性键,但前者是平面形分子,正负电荷重心重合,为非极性分子,而后者是三角锥形分子,正负电荷重心不重合,属于极性分子,故(a)错误;
(b)CO2、HCN分子的结构式分别是:O=C=O、H-C≡N,所以CO2含有2个σ键和2个π键,HCN分子中中含有2个σ键和2个π键,故(b)正确;
(c)H2S、O3分子中价层电子对都为3,中心原子采取SP3杂化,都是V形分子,故(c)错误;
(d)一种双环单萜龙脑(如图1)分子中有3个手性碳原子,故(d)错误;
故选:(b);
(2)a.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,所以第一电离能N大于O,故a正确;
b.同周期,自左而右,元素电负性逐渐增大,所以电负性O大于N,故b正确;
c.氮气分子和是等电子体,等电子体结构相似,以氮气分子的结构书写NO+的结构,故c正确;
d.N、O元素的价层电子排布分别为2s22p3,2s22p4,在周期表中都处于p区,故d正确;
故选:abcd;
(3)白球个数=2+4×
=4,黑球个数=1+8×
,所以白球和黑球个数比为2:1,根据二氧化硅的化学式知,白球表示氧原子;
故答案为:氧;
(4)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理知,该离子核外电子排布式为[Ar]3d6;该配合物中铁是中心离子,提供空轨道,氮原子提供孤电子对,根据图知其配位键个数是6;
故答案为:[Ar]3d6;6;
(5)二个乙酸分子间中,羧基上的氢原子与另一个乙酸分子中碳氧双键上氧原子形成氢键,所以其氢键表示为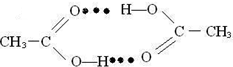 ,
,
故答案为: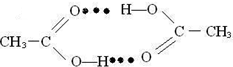 ;
;
(b)CO2、HCN分子的结构式分别是:O=C=O、H-C≡N,所以CO2含有2个σ键和2个π键,HCN分子中中含有2个σ键和2个π键,故(b)正确;
(c)H2S、O3分子中价层电子对都为3,中心原子采取SP3杂化,都是V形分子,故(c)错误;
(d)一种双环单萜龙脑(如图1)分子中有3个手性碳原子,故(d)错误;
故选:(b);
(2)a.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,所以第一电离能N大于O,故a正确;
b.同周期,自左而右,元素电负性逐渐增大,所以电负性O大于N,故b正确;
c.氮气分子和是等电子体,等电子体结构相似,以氮气分子的结构书写NO+的结构,故c正确;
d.N、O元素的价层电子排布分别为2s22p3,2s22p4,在周期表中都处于p区,故d正确;
故选:abcd;
(3)白球个数=2+4×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:氧;
(4)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理知,该离子核外电子排布式为[Ar]3d6;该配合物中铁是中心离子,提供空轨道,氮原子提供孤电子对,根据图知其配位键个数是6;
故答案为:[Ar]3d6;6;
(5)二个乙酸分子间中,羧基上的氢原子与另一个乙酸分子中碳氧双键上氧原子形成氢键,所以其氢键表示为
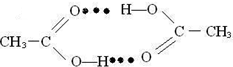 ,
,故答案为:
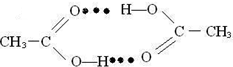 ;
;点评:本题考查较综合,涉及分子极性的判断、化学键类型、核外电子排布式的书写等知识点,难点是氢键的书写,明确哪些元素的原子能形成氢键,难度中等.

练习册系列答案
相关题目
 由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.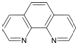 ),它能与Fe2+形成红色混合物(如图2),该配离子中Fe2+与氮原子形成配位键共有
),它能与Fe2+形成红色混合物(如图2),该配离子中Fe2+与氮原子形成配位键共有