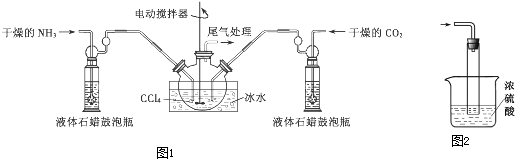
题目内容
10.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法;该法的工艺流程:
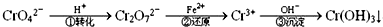
(1)第①步存在平衡,其反应方程式为:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,若平衡体系的pH=12,该溶液显黄色.
(2)能说明第①步反应达平衡状态的是C.
a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-) c.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要6mol的FeSO4•7H2O
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq);Ksp的表达式为Ksp=c(Cr3+)•c3(OH-).常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)沉淀完全,溶液的pH应调至5.
方法2:电解法
该法用Fe和石墨棒做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)Fe电极的电极反应式Fe-2e-=Fe2+.石墨电极的电极反应式2H++2e-═H2↑.
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)在氧化还原反应中,化合价升高值=化合价降低值=转移电子数来计算;
(4)根据Ksp=c(Cr3+)•c3(OH-)来计算氢氧根离子离子的浓度,并计算氢离子浓度和pH的大小;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.
解答 解:(1)c(OH-)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O左移,溶液呈黄色,故答案为:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O;黄;
(2)对于平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,
a.Cr2O72-和CrO42-的浓度相同,不一定平衡,故a错误;
b.2υ(Cr2O72-)=υ(CrO42-)不能证明正逆速率相等,所以不是平衡状态,故b错误;
c.溶液的颜色不变,即有色离子浓度不会再不变,达到了化学平衡状态,故c正确;
故答案为:c;
(3)还原1mol Cr2O72-离子,铬元素化合价从+6价降低到+3价,一共得到电子6mol,亚铁离子被氧化为+3价,应该得到6mol电子,所以还原1mol Cr2O72-离子,
需要6mol的FeSO4•7H2O,故答案为:6;
(4)Cr(OH)3在溶液中存在沉淀溶解平衡Cr(OH)3(s)?Cr3+(aq)+3OH-(aq),Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,则需c(OH-)=$\root{3}{\frac{{K}_{sp}}{c(C{r}^{3+})}}$=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,
故答案为:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq);Ksp=c(Cr3+)•c3(OH-);5;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;
故答案为:Fe-2e-=Fe2+;2H++2e-═H2↑.
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,难度中等,抓住题目信息是解题的关键.

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | G→a→c→f→b→d→c→b | B. | G→c→b→d→c→f→c→a | C. | G→a→e→f→b→d→c | D. | G→b→f→a→d→c→b |
| A. | ①中的离子反应方程式是:Na++NH3+CO2+H2O=NaHCO3↓+NH4+ | |
| B. | ②中的离子反应方程式是:2Na++CO32-+H2O+CO2=2NaHCO3↓ | |
| C. | 上述变化说明相同温度下溶解度Na2CO3>NaHCO3>NaCl | |
| D. | 向饱和CaCl2溶液中加入浓Ba(OH)2溶液,也会析出晶体 |
| A. | 用蒸发皿加热NaCl溶液 | |
| B. | 不慎将汞滴落到桌面上,应立即用较多的水冲洗 | |
| C. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| D. | 用瓷坩埚熔化氢氧化钠 |
| A. |  | B. |  | ||
| C. |  | D. |  |
 的是( )
的是( )| A. | CH3-CH═CH-CH3 | B. | CH2═CH2 | ||
| C. | CH2═CCH3CH3 | D. | 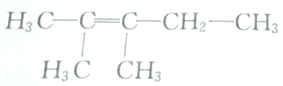 |
| A. | 若硫酸足量会有氢气生成 | |
| B. | 离子方程式为Cu2O+2H+=Cu2++Cu+H2O | |
| C. | 会得到蓝色溶液 | |
| D. | 氧化剂、还原剂均是Cu2O |
| A. | 转移电子4.8NA个 | B. | 生成气体的体积42.56L(标准状况) | ||
| C. | 还原剂比氧化剂多0.2mol | D. | 被还原的氮原子是11.2g |