题目内容
草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.
(1)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度.甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HIn?H++In-.则酸根离子In-的颜色是 .甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断).
(3)常温下有pH均为3的盐酸和草酸溶液各10ml,加水稀释,在右图画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注.
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全.
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1mol/L(NH4)2C2O4溶液pH值6.4.现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5mol/L,该溶液pH可能是 (填字母).
A.5 B.6 C.7 D.9.
(1)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10ml | 10ml | 40s |
| 40℃ | 20ml | 20ml |

(3)常温下有pH均为3的盐酸和草酸溶液各10ml,加水稀释,在右图画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注.
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全.
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1mol/L(NH4)2C2O4溶液pH值6.4.现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5mol/L,该溶液pH可能是
A.5 B.6 C.7 D.9.
分析:(1)反应速率与温度、浓度都成正比;
(2)草酸抑制甲基橙电离,碱促进甲基橙电离,草酸溶液呈酸性,则溶液呈红色,加入碱时,碱和草酸反应促进甲基橙电离,溶液呈黄色;
根据强酸制取弱酸分析;
(3)pH相等的盐酸和草酸,草酸是弱酸,盐酸是强酸,加水稀释促进草酸电离,则在电离过程中,草酸中氢离子浓度大于盐酸;
(4)根据c(Mg2+)?c(C2O42-)与溶度积常数相对大小判断是否完全沉淀,如果c(Mg2+)?c(C2O42-)小于溶度积常数,则完全沉淀;
(5)根据溶液中阴阳离子水解及水解程度相对大小来分析解答.
(2)草酸抑制甲基橙电离,碱促进甲基橙电离,草酸溶液呈酸性,则溶液呈红色,加入碱时,碱和草酸反应促进甲基橙电离,溶液呈黄色;
根据强酸制取弱酸分析;
(3)pH相等的盐酸和草酸,草酸是弱酸,盐酸是强酸,加水稀释促进草酸电离,则在电离过程中,草酸中氢离子浓度大于盐酸;
(4)根据c(Mg2+)?c(C2O42-)与溶度积常数相对大小判断是否完全沉淀,如果c(Mg2+)?c(C2O42-)小于溶度积常数,则完全沉淀;
(5)根据溶液中阴阳离子水解及水解程度相对大小来分析解答.
解答:解:(1)反应速率与温度、浓度都成正比,二者的温度和浓度都相等,则反应速率相等,则反应速率相等,则褪色时间相等,故答案为:40s;
(2)甲基橙的变色范围是3.1~4.4,小于3.1时显红色,大于4.4时显黄色,根据甲基橙的电离方程式可知,当溶液碱性增强时平衡是向正反应方向移动的,所以该酸根的颜色是显黄色的,因为草酸钠溶液水解显碱性,此时甲基橙显黄色,若草酸的酸性弱于甲基橙的,则在草酸溶液中甲基橙显黄色,所以通过颜色的变化无法判断滴定终点,因此草酸的酸性要强于甲基橙的,这样在滴定过程中颜色才能发生变化,
故答案为:黄色;前者弱;
(3)盐酸是强酸,草酸是弱酸,存在电离平衡,所以在稀释过程中盐酸中氢离子的浓度始终小于草酸中氢离子的浓度.但当无限稀释时二者的PH均要无限接近7,所以其图象为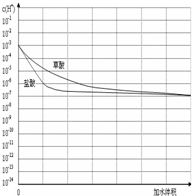 ,故答案为:
,故答案为: ;
;
(4)1 L0.01 mol/LMgCl2溶液中的Mg2+的物质的量是0.01mol,100 mL0.1 mol/L的(NH4)2C2O4溶液的物质的量也是0.01mol,即二者恰好反应.根据溶解平衡MgC2O4(s)?Mg2+(aq)+C2O42-(aq)可知c(Mg2+)?c(C2O42-)=Ksp=8.1×10-5
因为c(Mg2+)=c(C2O42-),所以c(Mg2+)=(8.1×10-5)-1/2=9×10-3 mol/L>10-5 mol/L
故Mg2+未沉淀完全,
答:镁离子未程度完全;
(5)常温下由水电离出的c(H+)=1.0×10-5mol/L,说明该溶液中水的电离是被促进的,若只有阳离子水解,则溶液显酸性,即此时溶液的pH为5;若只有阴离子水解,则溶液显碱性,此时溶液中的c(OH-)=1.0×10-5mol/L,则溶液中的c(H+)=1.0×10-9mol/L所以溶液的pH是9;若溶液阴离子和阳离子同时都水解,若阳离子的水解程度大于阴离子的水解程度,则溶液显碱性;若阳离子的水解程度小于阴离子的水解程度,则溶液显酸性;阳离子的水解程度和阴离子的水解程度相同,则溶液显中性,
故选ABCD.
(2)甲基橙的变色范围是3.1~4.4,小于3.1时显红色,大于4.4时显黄色,根据甲基橙的电离方程式可知,当溶液碱性增强时平衡是向正反应方向移动的,所以该酸根的颜色是显黄色的,因为草酸钠溶液水解显碱性,此时甲基橙显黄色,若草酸的酸性弱于甲基橙的,则在草酸溶液中甲基橙显黄色,所以通过颜色的变化无法判断滴定终点,因此草酸的酸性要强于甲基橙的,这样在滴定过程中颜色才能发生变化,
故答案为:黄色;前者弱;
(3)盐酸是强酸,草酸是弱酸,存在电离平衡,所以在稀释过程中盐酸中氢离子的浓度始终小于草酸中氢离子的浓度.但当无限稀释时二者的PH均要无限接近7,所以其图象为
 ,故答案为:
,故答案为: ;
;(4)1 L0.01 mol/LMgCl2溶液中的Mg2+的物质的量是0.01mol,100 mL0.1 mol/L的(NH4)2C2O4溶液的物质的量也是0.01mol,即二者恰好反应.根据溶解平衡MgC2O4(s)?Mg2+(aq)+C2O42-(aq)可知c(Mg2+)?c(C2O42-)=Ksp=8.1×10-5
因为c(Mg2+)=c(C2O42-),所以c(Mg2+)=(8.1×10-5)-1/2=9×10-3 mol/L>10-5 mol/L
故Mg2+未沉淀完全,
答:镁离子未程度完全;
(5)常温下由水电离出的c(H+)=1.0×10-5mol/L,说明该溶液中水的电离是被促进的,若只有阳离子水解,则溶液显酸性,即此时溶液的pH为5;若只有阴离子水解,则溶液显碱性,此时溶液中的c(OH-)=1.0×10-5mol/L,则溶液中的c(H+)=1.0×10-9mol/L所以溶液的pH是9;若溶液阴离子和阳离子同时都水解,若阳离子的水解程度大于阴离子的水解程度,则溶液显碱性;若阳离子的水解程度小于阴离子的水解程度,则溶液显酸性;阳离子的水解程度和阴离子的水解程度相同,则溶液显中性,
故选ABCD.
点评:本题考查了弱电解质的电离、难溶物的溶解平衡、盐类水解等知识点,根据弱电解质的电离特点、溶度积常数、盐类水解特点来分析解答即可,难点是(5)题,注意阴阳离子都水解的情况,往往漏掉而导致错误.

练习册系列答案
相关题目




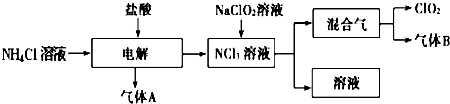
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.