题目内容
(6分)把2.56g纯铜放入盛有一定量浓硝酸的大试管中,立即发生反应,当铜反应完毕后,共生成1.12L气体(标况),计算反应中耗用硝酸的物质的量是多少?(要求写出计算过程)
0.13mol
试题分析:n(Cu)=
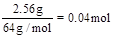 ,则溶液中的n(NO3-)=2n(Cu)=0.08mol。反应完毕后共生成1.12L气体,无论气体是NO还是NO2,消耗硝酸的量都为
,则溶液中的n(NO3-)=2n(Cu)=0.08mol。反应完毕后共生成1.12L气体,无论气体是NO还是NO2,消耗硝酸的量都为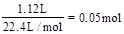 。根据原子守恒可知,反应中消耗硝酸的总量为0.05mol+0.08mol=1.3mol。
。根据原子守恒可知,反应中消耗硝酸的总量为0.05mol+0.08mol=1.3mol。点评:硝酸与金属反应,硝酸在反应过程中一部分做氧化剂,变成气体,一部分起酸的作用,以NO3-的形式存在溶液中。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目