题目内容
7.下列溶液中有关微粒的物质的量浓度关系错误的是( )| A. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(NH4+)+c(OH-)>c(Cl-)+c(H+) | |
| B. | 等体积、等物质的量浓度为Na2CO3溶液与NaHCO3溶液混合后:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序为:②>③>① | |
| D. | 0.1 mol/L Na2CO3溶液与0.1 mol/L HCl溶液等体积混合,所得溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
分析 A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合后,溶液中存在物料守恒,根据物料守恒判断;
C.氢离子抑制铵根离子水解,硫酸铵和氯化铵中铵根离子水解程度相同;
D.等物质的量浓度、等体积的碳酸钠和稀盐酸混合,二者恰好反应生成碳酸氢钠,根据质子守恒判断.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(NH4+)++c(H+)=c(OH-)+c(Cl-),氨水有剩余,一水合氨电离程度大于铵根离子水解程度,溶液呈碱性,则c(NH4+)+c(OH-)>c(Cl-)+c(H+),故A正确;
B.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合后,溶液中存在物料守恒,根据物料守恒得2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故B错误;
C.氢离子抑制铵根离子水解,硫酸铵和氯化铵中铵根离子水解程度相同,所以离子浓度大小顺序是:②>③>①,故C正确;
D.等物质的量浓度、等体积的碳酸钠和稀盐酸混合,二者恰好反应生成碳酸氢钠,根据质子守恒得c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D正确;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意电荷守恒和物料守恒的判断,注意A中离子关系,为易错点.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
17.如图所示的钢铁腐蚀中,下列说法正确的是( )
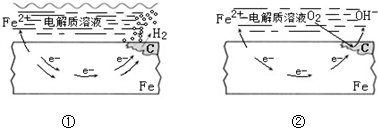

| A. | ①、②中的Fe都发生的是还原反应 | |
| B. | ①表面的电解质溶液可以为NaCl溶液 | |
| C. | 生活中钢铁制品的腐蚀以图①所示为主 | |
| D. | 图②中,正极反应式为O2+4e-+2H2O═4OH- |
18.运动时随着汗液会流失大量盐分,如果只补充纯净水会进一步加重体内电解质紊乱.此时最好喝一些( )
| A. | 食醋 | B. | 食盐水 | C. | 啤酒 | D. | 茶水 |
15.下列水溶液中能大量共存的一组离子是( )
| A. | K+、Al3+、CO32-、Cl- | B. | K+、Fe3+、HCO3-、S2- | ||
| C. | H+、Mg2+、SO42-、Cl- | D. | H+、Fe2+、Cl-、NO3- |
12.下列说法不正确的是( )
| A. | 据报道,《自然》在2013年2月介绍了由浙江大学用石墨烯制造出的目前世界上最轻固体材料“碳海绵”,碳海绵与金刚石的关系可能是同素异形体 | |
| B. | 2013年浙江省多地遭遇雾霾天气,有报道称雾霾颗粒中汽车尾气占20%以上,已知汽车尾气中的主要污染物为NOX、CO、燃烧源超细颗粒(PM2.5)等有害物质,其中PM2.5(PM单位为百万分之一米)颗粒大小约等于胶体粒子 | |
| C. | 石头纸就是用磨成粉末的石灰石为主要原料,加上15%高分子有机材料聚乙烯和5%胶合剂做成.可以应用在笔记本,纸袋,餐盒等许多用途上,这种纸防水不易燃烧,最重要的是不用砍树造纸,非常环保,还能为国家节约大量的石油资源 | |
| D. | 与传统的石油系油墨相比,大豆油墨有相当多的优点:主要含食用色拉油,可再生,无危害,耐擦.通常报纸用纸80%以上采用再生纸,利用大豆油墨比普通油墨更容易脱墨的特性,废纸回收再生时废料少,回收成本低,新闻报纸行业可选择用乙醇等有机溶剂进行脱墨 |
19.下列说法正确的是( )
| A. | 摩尔是一种国际基本物理量 | |
| B. | 标准状况下气体摩尔体积约为22.4 L | |
| C. | 在同温同压下,相同体积的任何单质所含分子数相同 | |
| D. | 1 mol氧原子的质量为16 g |
16.下列分离与提纯的方法不正确的是( )
| A. | 除去氯化钠溶液中的泥沙可以使用过滤的方法 | |
| B. | 提取溴水中的溴单质用四氯化碳萃取 | |
| C. | 从含有少量氯化钠的硝酸钾溶液中提取硝酸钾可以使用结晶的方法 | |
| D. | 分离汽油和水使用蒸馏的方法 |
9.下列叙述正确的是( )
| A. | SO2具有漂白性,能使碘的淀粉溶液由蓝色变为无色 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 少量金属钠通常保存在煤油中,着火时可用细沙覆盖灭火 | |
| D. | 实验室中用石灰水区分Na2CO3与NaHCO3两瓶无标签溶液 |