题目内容
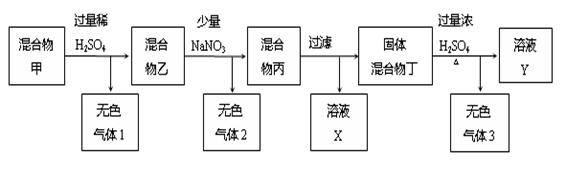
(11分)由C、Cu、FeCO3、铜锈[主要成分为Cu2(OH)2CO3]组成的固体混合物,进行了如下所示的实验过程:
回答下列问题:
(1)无色气体1的成分是: 。
(2)混合物乙中加入NaNO3后,写出一个可能产生无色气体2的反应的离子方程式:
(3)溶液X中含有的金属阳离子是 。
(4)无色气体3成分是 ,已知固体混合物丁的的质量为5.6g,在标准状况下无色气体3的体积为14.56L,求无色气体3各成分的物质的量: 。(写出具体的计算过程)

回答下列问题:
(1)无色气体1的成分是: 。
(2)混合物乙中加入NaNO3后,写出一个可能产生无色气体2的反应的离子方程式:
(3)溶液X中含有的金属阳离子是 。
(4)无色气体3成分是 ,已知固体混合物丁的的质量为5.6g,在标准状况下无色气体3的体积为14.56L,求无色气体3各成分的物质的量: 。(写出具体的计算过程)
(1)CO2 (2分)
(2) 3Cu + 2NO3- + 8H+= 3Cu2+ + 2NO↑ + 4H2O 或
3Fe2+ + NO3- + 4H+= 3Fe3+ + NO↑ + 2H2O(2分)
(3)Cu2+、Fe2+、Na+(2分)(漏填或错填1个扣1分)
(4)CO2 、SO2 (1分)CO2:0.2mol、SO2 :0.45mol(4分)(无具体的计算过程得2分)
试题分析:(1)稀硫酸与FeCO3、铜锈[主要成分为Cu2(OH)2CO3]反应生成二氧化碳气体;(2)加入NaNO3后在酸性条件下,NO3-具有强氧化性,与还原性物质Cu和Fe2+反应生成NO气体;因为加入少量NaNO3,故NO3-优先氧化还原性强的Cu,溶液中含有Cu2+、Fe2+、Na+;(4)固体混合物丁中一定含有碳,可能含有铜,如只含有碳,则5.6g碳可生成气体5.6÷12×3×22.4=31.36L故固体应为碳和铜的混合物,反应方程式为C+2H2SO4=2SO2+CO2+2H2O Cu+2H2SO4=SO2+CuSO4+2H2O;根据方程式可得等式为12n(C)+64n(Cu)=5.6
3n(C)+ n(Cu)=14.56÷22.4[气体物质的量]
解得CO2:0.2mol、SO2 :0.45mol

练习册系列答案
相关题目