题目内容
对于反应:TiCl4+4Na=4NaCl+Ti,下列说法正确的是
| A.该反应说明钠是强还原剂,可用于冶炼金属 |
| B.该反应条件是TiCl4在熔融状态或水溶液中 |
| C.Ti是氧化剂 |
| D.TiCl4是还原剂 |
A
解析试题分析:在TiCl4+4Na=4NaCl+Ti反应中,Na是还原剂,TiCl4是氧化剂,该反应只能在熔融状态下进行,水溶液中,钠与水反应,所以A正确。
考点:氧化还原反应

练习册系列答案
相关题目
下列叙述中,正确的是
| A.只含有金属元素的离子不一定是阳离子 |
| B.金属阳离子被还原不一定得到金属单质 |
| C.氧化还原反应中,非金属单质必是氧化剂 |
| D.元素从化合态变为游离态时,一定被还原 |
下列反应中,硝酸既表现酸性,又表现氧化性的是( )。
| A.Fe2O3跟稀硝酸反应 | B.铜跟稀硝酸反应 |
| C.CuO跟稀硝酸反应 | D.Al(OH)3跟稀硝酸反应 |
工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
| A.若管道漏气遇氨就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应NH3被还原 | D.生成1 mol N2有6 mol电子转移 |
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。则下列说法正确的是
| A.反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D.若反应中转移的电子数目为6.02×1023,生成22.4L NO气体 |
根据表中信息判断,下列选项不正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4 ...... |
| ② | Cl2 、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-...... | Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比小于或等于1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂,C是还原剂 | B.每生成1molCO需转移2mol电子 |
| C.AlN中氮元素的化合价为+3 | D.AlN的摩尔质量为41 |
下列反应肯定不属于氧化还原反应的是
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
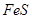 与一定浓度的
与一定浓度的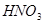 反应,生成
反应,生成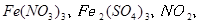
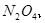
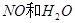 ,当
,当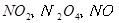 的物质的量之比为
的物质的量之比为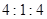 时,实际参加反应的
时,实际参加反应的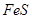 与
与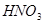 的物质的量之比为( )。
的物质的量之比为( )。
| A.1:6 | B.2:15 | C.2:3 | D.16:25 |