题目内容
在①浓盐酸 ②浓硝酸 ③浓硫酸 ④稀硫酸 ⑤稀硝酸等物质中,能用铝槽车盛装的是( )
| A、①②③ | B、②③ | C、②④ | D、③⑤ |
分析:铝能与盐酸、稀硫酸、稀硝酸反应,但常温下铝在浓硫酸、浓硝酸中发生钝化,据此判断.
解答:解:①在金属活动顺序表中,铝排在氢的前面,铝与浓盐酸反应2Al+6HCl=2AlCl3+3H2↑,生成氯化铝和氢气,故不能用铝槽车来运送,故①错误;
②常温下,铝在浓硝酸中发生钝化现象,生成一层致密的氧化物保护膜,阻止内部金属与浓硝酸继续反应,故能用铝槽车来运送,故②正确;
③常温下,铝在浓硫酸中发生钝化现象,生成一层致密的氧化物保护膜,阻止内部金属与浓硫酸继续反应,故能用铝槽车来运送,故③正确;
④在金属活动顺序表中,铝排在氢的前面,所以铝与稀硫酸能反应且生成硫酸铝和氢气,反应的化学方程式为:2Al+3H2SO4═Al2(SO4)3+3H2↑,故不能用铝槽车来运送,故④错误;
⑤铝在稀硝酸中不能发生钝化,铝与稀硝酸反应Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,故不能用铝槽车来运送,故⑤错误;
故选B.
②常温下,铝在浓硝酸中发生钝化现象,生成一层致密的氧化物保护膜,阻止内部金属与浓硝酸继续反应,故能用铝槽车来运送,故②正确;
③常温下,铝在浓硫酸中发生钝化现象,生成一层致密的氧化物保护膜,阻止内部金属与浓硫酸继续反应,故能用铝槽车来运送,故③正确;
④在金属活动顺序表中,铝排在氢的前面,所以铝与稀硫酸能反应且生成硫酸铝和氢气,反应的化学方程式为:2Al+3H2SO4═Al2(SO4)3+3H2↑,故不能用铝槽车来运送,故④错误;
⑤铝在稀硝酸中不能发生钝化,铝与稀硝酸反应Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,故不能用铝槽车来运送,故⑤错误;
故选B.
点评:本题考查铝的性质,难度较小,注意钝化现象为常温,常见金属为铁、铝在浓硫酸、浓硝酸发生钝化.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
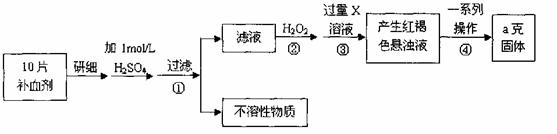
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发现的有关问题。
Ⅰ.探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的浓硫酸、稀硫酸、浓硝酸、稀硝酸,实验结果记录如下表:
| 酸 | 实验结果 |
a | 浓硫酸 | 加热后发生反应,产生无色刺激性气体 |
b | 稀硫酸 | 加热也不发生反应 |
c | 浓硝酸 | 不加热即发生反应,产生红棕色气体 |
d | 稀硝酸 | 微热发生反应,产生无色气体 |
①由上表中实验结果,四种酸的氧化性由强到弱的顺序是 。
②由上表可知,铜与稀硫酸在加热条件下不反应,但若同时通入O2,铜片能逐渐溶解,溶液变为蓝色。写出该反应的化学方程式:?????????????? ?????????????????????????????????????????????????
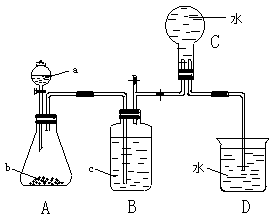
(2)先将铜与浓硫酸反应产生的气体X持续通入如图所示装置中,一段时间后再将铜与浓硝酸产生的气体Y也持续通入该装置中,则整个过程中可观察到的现象包括 (填字母)。

A.通入X气体后产生白色沉淀
B.通入X气体后溶液无明显现象
C.通入Y气体后产生沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是 (填字母)。
A.硝酸的酸性比硫酸强
B.H2SO3的酸性比盐酸强
C.HNO3能氧化H2SO3(或SO2)
D.BaSO4既不溶于水也不溶于HNO3溶液
Ⅱ.如图是某同学探究铜与稀硝酸反应的还原产物的实验装置图,请回答下列问题:

(1)写出铜与稀硝酸反应的离子方程式: 。
(2)已知装置气密性良好,请简述利用该装置证明铜与稀硝酸反应生成的气体产物是NO的操作过程: