题目内容
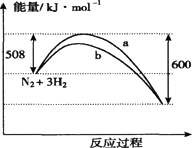
如图,a曲线是198K、101kPa时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
A.该反应的热化学方程式为:N2+3H2
 2NH3△H=-92kJ/mol
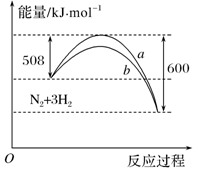
2NH3△H=-92kJ/molB.b曲线是升高温度时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在198K、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2 Q1
【答案】分析:A、从热化学方程式的要求分析;
B、从催化剂的作用分析;
C、从催化剂的效果分析;
D、从化学平衡的移动与反应热的具体数值分析.
解答:解:A、热化学方程式必须注明物质的状态,故A错误.
B、b曲线的活化能降低,是加入催化剂的原因,故B错误;
C、催化剂降低活化能,不改变反应热数值,故C错误;
D、通入2molN2和6molH2后,体积一定,压强增大,反应向正反应方向移动,故Q2>2Q1,又因为反应为可逆反应,不会反应完全,故184>Q2,故D准确;
故选D.
点评:本题考查化学能与热能的相互转化,加入催化剂能降低活化能,不改变反应热.
B、从催化剂的作用分析;
C、从催化剂的效果分析;
D、从化学平衡的移动与反应热的具体数值分析.
解答:解:A、热化学方程式必须注明物质的状态,故A错误.
B、b曲线的活化能降低,是加入催化剂的原因,故B错误;
C、催化剂降低活化能,不改变反应热数值,故C错误;
D、通入2molN2和6molH2后,体积一定,压强增大,反应向正反应方向移动,故Q2>2Q1,又因为反应为可逆反应,不会反应完全,故184>Q2,故D准确;
故选D.
点评:本题考查化学能与热能的相互转化,加入催化剂能降低活化能,不改变反应热.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
 2NH3 ΔH=-92 kJ/mol
2NH3 ΔH=-92 kJ/mol 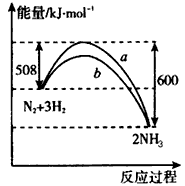
 2NH3 △H=-92 kJ/mol
2NH3 △H=-92 kJ/mol