题目内容
用水稀释0.1 mol·L-1氨水时,溶液中随着水量的增加而减小的是( )
| A.c(OH-)/c(NH3·H2O) |
| B.c(NH3·H2O)/c(OH-) |
| C.c(H+)和c(OH-)的乘积 |
| D.OH-的物质的量 |
B
解析试题分析:A、B.由NH3.H2O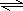 OH-+NH4+可知,加水促进电离,则n(NH3.H2O)减少,n(OH-)增大,所以二者的比值减小,故B正确;
OH-+NH4+可知,加水促进电离,则n(NH3.H2O)减少,n(OH-)增大,所以二者的比值减小,故B正确;
C.因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故C错误;
D.由NH3.H2O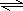 OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故D错误;
OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故D错误;
故选B.
考点:弱电解质的电离平衡
点评:本题考查弱电解质的电离,明确稀释时电离平衡的移动及离子的物质的量、离子的浓度的变化是解答的关键

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
(14分)I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH=a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH=a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
 ”“<”或“=”)
”“<”或“=”)②已知:
N2 (g) + 3H2(g)
 2NH3 (g) ΔH=-92.4kJ·mol-1,
2NH3 (g) ΔH=-92.4kJ·mol-1,2H2 (g) + O2 (g)===2H2O (l) ΔH=-571.6kJ·mol-1,
则2N2 (g) + 6H2O(l)
 4NH3 (g) + 3O2 (g) ΔH= ;
4NH3 (g) + 3O2 (g) ΔH= ;(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是 (填字母标号)
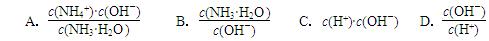
II.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g)
 2SO3 (g) ΔH=-196.0kJ·mol-1
2SO3 (g) ΔH=-196.0kJ·mol-1①容器体积不变时,为了提高SO2的转化率,可采用的措施是 (填字母标号)
| A.加入V2O5作催化剂 | B.使用过量SO2 | C.高温 | D.通入过量空气 |
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将 (填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将 。