题目内容
(16分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧是将瓷坩埚置于 上(用以下所给仪器编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是( )(填字母编号,有两个选项符合题意。)
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解成铜 d.该条件下铜无法被氧化
(3)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比途径Ⅱ有明显的两个优点:
、
【答案】
(1)C,e,b(每空3分)
(2)( ab )(3分,两个选项符合题意。若只选一个且正确的给1分,但只要选错一个就得0分。)
(3)(每空2分) 产生等量的胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体
【解析】

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
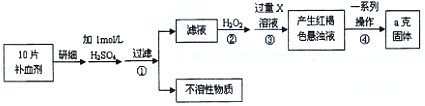

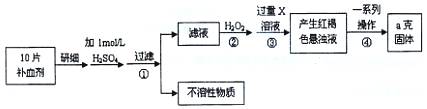
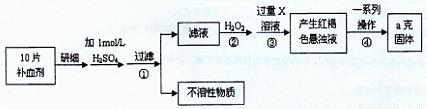
 请回答下列问题:
请回答下列问题: 铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)